Comment équilibrer une équation chimique

Thème A3
Les
transformations
chimiques
Reconnaître, Classer et Équilibrer les
réactions chimiques.

Antoine Lavoisier (1722)
Loi de la conservation
de la masse
Conclusion: Dans une
réaction chimique, la
somme des masses
des réactifs est égale à
la somme des masses
des produits.

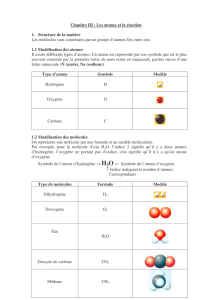
A3.2 L’écriture des équations
chimiques
Comment équilibrer une
équation chimique

Réactifs: méthane, oxygène
Produits: dioxyde de carbone, eau

L’équation chimique
méthane + oxygène ----) dioxyde de carbone + eau
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%