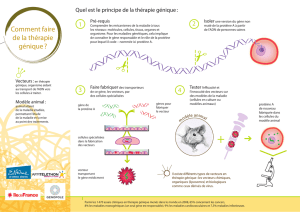
La thérapie génique - Académie de Grenoble

Myriam Vial
PAP Génétique - Lycée Marlioz, Aix Les Bains -
15 juin 2004

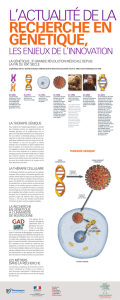
Définition
•La thérapie génique consiste à :
introduire dans une ¢-cible
un gène d’intérêt thérapeutique
afin qu’il produise
- une protéine manquante (¢ déficiente)
ou
-un signal qui conduira à la mort de la cellule (¢
infectée ou ¢ cancéreuse).


L’avènement de la thérapie génique
•Début des années 80 : développement du génie
génétique ==> maîtrise de nouveaux procédés
techniques au niveau cellulaire, tels que
l’exploration du génome humain.
•1990 : début des 1ers tests cliniques de la
thérapie génique.
•Approche innovante, nouvelle étape dans
l’histoire de la médecine, car elle contre
directement les causes de la maladie (au lieu
d’attaquer slt les symptômes).

La 1ère réussite
DÉCRYPTAGE. POUR LA PREMIÈRE FOIS UNE THÉRAPIE
GÉNIQUE MONTRE SON EFFICACITÉ.
Les bébés sortent de leurs bulles
Des médecins de l’hôpital Necker de Paris ont réussi à
traiter par thérapie génique quatre " enfants bulles "
atteints de déficit immunitaire combiné sévère. Cette
première mondiale est une réussite. Reste à savoir si la
guérison est temporaire ou définitive.
Première mondiale d’une thérapie génique efficace à
l’hôpital Necker. Grâce à l’utilisation de la thérapie
génique, difficile opération ……
Article paru dans l'édition du 30 décembre 1999 - Page imprimée sur http://www.humanite.fr
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
1
/
47
100%