cours_transfection_060306 Marie B

TP master 1
Transfection

La transfection des cellules eucaryotes
Définition et Principe
Transfert de gènes (ADNc) codant pour une protéine dans une cellule
= protéine exogène
Transfection Infection (méthode virale)
Surexpression de cette protéine grâce à la machinerie cellulaire
(transcription/traduction)
ribosomes
ARN
protéine
exogène
ADN
(2) Etude
in situ
(1) Etude à partir de
lysat protéique
(activité enzymatique)
Une cellule eucaryote

Techniques
Réactifs chimiques
- Calcium phosphate
- DEAE-dextran
- Liposomes artificiels
Méthodes physiques
- Microinjection directe (dans la cellule ou le noyau) :
animaux transgéniques
- Electroporation (perturbation de la membrane par un choc électrique)
-Propulsion de microprojectiles contenant de l’ADN (in vivo) :
plantes
Utilisation de particules virales
- Rétrovirus
- Adénovirus
- Particules virales non infectieuses

Réactifs chimiques
DEAE-dextran
1965 par Vaheri et Pagano
Technique classique, in vitro
DEAE-dextran = polymère cationique
Association avec les acides nucléiques chargés négativement
Endocytose cytoplasme noyau

Réactifs chimiques
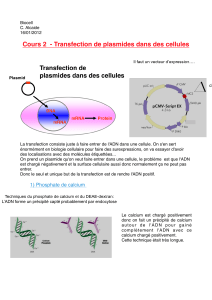
Calcium phosphate
1973 par Graham et van der Eb
Technique classique et bon marché, in vitro
Mise en contact de l’ADN avec du chlorure de calcium dans un tampon phosphate
Formation d’un précipité entre le calcium et l’ADN
Précipité dans la cellule par endocytose ou phagocytose
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%