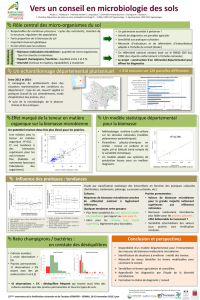
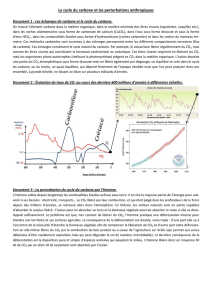
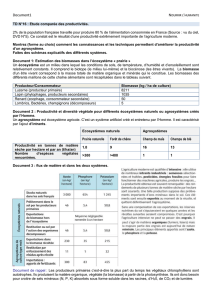
Stœchiométrie des communautés microbiennes

i
Pauline BRYERE Master 2 EFCE
Année 2009-2010
Stœchiométrie des communautés microbiennes :
comparaison d’écosystèmes aquatiques et terrestres
Encadrement : Myriam Bormans et André-Jean Francez
UMR ECOBIO 6553
Equipe Rôle de la Biodiversité dans les Processus Ecologiques

ii
REMERCIEMENTS
Je tiens tout d‟abord à remercier mes deux maîtres de stage, Myriam Bormans et
André-Jean Francez, pour m‟avoir fait confiance et pour avoir toujours été disponibles lorsque
j‟avais besoin d‟eux mais aussi pour leurs conseils.
Je voudrais également remercier tout particulièrement Natalie Josselin et Marie-Paule
Briand pour leur infinie patience et leur disponibilité. Sans leurs précieuses explications et
leur dynamisme (il en faut pour tous les allers-retours entre les étages et les bâtiments, surtout
quand il ne manque qu‟une fiole) je n‟aurais sans doute pas pu mener à terme les nombreuses
analyses effectuées dans les temps requis.
Mes remerciements vont également à Alexandrine, pour son aide dans l‟identification
du phytoplancton et du zooplancton et pour le dosage de la chlorophylle ainsi qu‟à Guillaume,
pour les profils. Merci à vous deux pour votre aide précieuse lors des sorties « aquatiques ».
Je voudrais enfin remercier la promo EFCE, pour cette année qui est passée trop vite.
Merci en particulier à Julia (qui se réveille en même temps que moi à l‟autre bout de la ville
quand je mets mon réveil à 6h), Solène et Camille pour le soutien mutuel, les fous rires, tous
les moments passés ensemble... Merci aussi à Pauline, Natacha, Emilien, Amaury, Michel,
Quentin et Guillaume sans qui cette année n‟aurait pas été la même. Je finirais par un
remerciement spécial à Nicolas, qui a eu le courage de me supporter et de me soutenir tout au
long de la rédaction de ce rapport.

iii
SOMMAIRE
INTRODUCTION .................................................................................................................................................. 1
MATERIEL ET METHODES ................................................................................................................................... 3
I/ DESCRIPTION DES SITES DE PRELEVEMENTS ..................................................................................................... 3
1) Prélèvements en milieu terrestre ....................................................................................... 3
2) Prélèvements en milieu aquatique .................................................................................... 3
II/ PREPARATION DES ECHANTILLONS ET ANALYSES .............................................................................................. 4
1) Préparation des échantillons ............................................................................................. 4
a. Sol et litière ......................................................................................................... 4
b. Echantillons d’eau et filtres ................................................................................. 5
2) Analyses............................................................................................................................ 5
a. Carbone .............................................................................................................. 6
b. Azote .................................................................................................................. 6
c. Phosphore ........................................................................................................... 6
d. Chlorophylle a ..................................................................................................... 7
e. Identification des espèces composant les communautés planctoniques .............. 7
III/ ANALYSES DES DONNEES ........................................................................................................................... 7
RESULTATS ......................................................................................................................................................... 8
I/ MILIEU TERRESTRE .................................................................................................................................... 8
1) Rapport C/N ...................................................................................................................... 8
2) Effet des facteurs « sites » et « substrat » sur les autres variables ..................................... 9
3) Corrélations entres les différentes variables ...................................................................... 9
II/ MILIEU AQUATIQUE ............................................................................................................................... 11
1) Identification des espèces dans les différentes fractions .................................................. 11
2) Rapports C/N, C/P et N/P ................................................................................................ 12
a. Réservoir de La Chèze ........................................................................................ 14
b. Etang des Long Champs .................................................................................... 14
3) Chlorophylle a ................................................................................................................. 15
DISCUSSION ...................................................................................................................................................... 16
I/ MILIEU TERRESTRE .................................................................................................................................. 16
II/ MILIEU AQUATIQUE ............................................................................................................................... 18
III/ COMPARAISON DES DEUX TYPES DE MILIEU ................................................................................................ 21
BIBLIOGRAPHIE ................................................................................................................................................ 23

1
INTRODUCTION
La stœchiométrie écologique permet une approche différente de l‟approche classique
utilisée en écologie pour étudier les relations trophiques. En effet, alors que les interactions
entre les organismes et des organismes avec leur milieu sont souvent analysées à des échelles
allant de l‟individu à l‟écosystème, la stœchiométrie écologique propose une approche basée
sur les éléments chimiques. Cette discipline étudie ainsi l‟équilibre des éléments chimiques au
sein des organismes dans leur milieu. Elle s‟intéresse également aux flux d‟énergie et de
matière au sein des écosystèmes (Sterner et Elser, 2002). Les études sont principalement
centrées sur le carbone (C) l‟azote (N) et le phosphore (P), considérés comme des éléments
essentiels à la structure et au développement cellulaire. L‟utilisation des ratios de ces trois
éléments chimiques permet une meilleure compréhension des réseaux trophiques et des
écosystèmes sur plusieurs échelles, du contenu macromoléculaire aux processus écologiques
dans leur globalité (Persson et al., 2010).
Deux principes fondamentaux régissent la stœchiométrie écologique : la conservation
de la matière (les quantités de chaque élément sont conservées dans les transferts réalisés au
sein des chaînes trophiques) et l‟homéostasie. Initialement, l‟homéostasie est la capacité que
peut avoir un système quelconque à conserver son équilibre de fonctionnement en dépit des
contraintes qui lui sont extérieures. Le terme a été repris en biologie et défini comme la
capacité des organismes à garder leur composition en éléments constante indépendamment
des changements de composition chimique pouvant intervenir dans leur environnement et les
ressources utilisées (Kooijman, 1995). Les organismes peuvent ainsi être caractérisés par une
homéostasie stricte, c‟est-à-dire que les changements de stœchiométrie de la ressource
n‟induisent pas de variation dans la composition de l‟organisme. C‟est le cas de la majorité
des hétérotrophes qui, par des mécanismes pré-ingestion (sélection de la nourriture) et post-
ingestion (excrétion) (Hall, 2009 ; Persson et al., 2010) sont capables de réguler leur
concentration interne en éléments. A l‟inverse, les organismes autotrophes peuvent présenter
des variations de leur stœchiométrie en réponse aux changements de composition du milieu
(Droop, 1974 ; Ågren, 2004, 2008). La stœchiométrie des organismes non-homéostatiques
peut suivre celle de la ressource selon une relation 1 : 1 ou diverger de cette relation, les ratios
des organismes augmentant plus ou moins rapidement que ceux de la ressource (Rhee, 1978).
Ces variations sont notamment possibles grâce à une « consommation de luxe » qui leur
permet de stocker différents éléments en excès dans l‟environnement (Klausmeier et al, 2004,
2008).

2
En 1958, Redfield montrait que le rapport C : N : P du phytoplancton marin, d‟une
valeur molaire de 106 : 16 : 1, est similaire à celui des eaux des océans. Il a également
observé que l‟abondance des éléments et leurs ratios dans ces milieux sont contraints,
suggérant que les fortes interactions entre les organismes et leur environnement entraînent les
similarités observées au sein des ratios. Cet exemple de référence en stœchiométrie
écologique est depuis au centre de la compréhension des écosystèmes marins (physiologie
végétale, limitation de la production primaire par la ressource, échanges de CO2 entre l‟océan
et l‟atmosphère, cycle de l‟azote dans l‟océan…). Il a permis de mieux comprendre l‟impact
des processus biologiques sur la matrice globale de l‟océan. Le rapport de Redfield montre
l‟importance de relier la stœchiométrie des organismes aux flux biogéochimiques, notamment
dans l‟étude des réseaux trophiques.
L‟objectif de mon stage a été de réaliser une étude comparative de stœchiométrie
écologique des communautés de micro-organismes d‟écosystèmes aquatiques et terrestres,
sélectionnés selon leur niveau trophique (oligotrophe et eutrophe). Nous nous sommes
intéressés à la relation biomasse microbienne-ressource d‟un point de vue stœchiométrique,
sur la base d‟analyses C /N /P effectuées sur ces communautés ainsi que sur la ressource
disponible dans le milieu. Les milieux aquatiques et terrestres présentent un certains nombre
de différences, notamment en ce qui concerne la distribution de la ressource. En l‟absence
d‟un processus d‟homogénéisation tel que la turbulence en milieu aquatique, la matrice du
milieu terrestre présente une grande hétérogénéité. La ressource est ainsi distribuée de
manière plus hétérogène en milieu terrestre qu‟en milieu aquatique (McGroddy et al., 2004 ;
Cleveland et Liptzin, 2007). Les communautés de micro-organismes étudiées en milieu
aquatique sont constituées en majorité de phytoplancton et de quelques espèces de
zooplancton alors que celle présentes en milieu terrestre sont dominées par les bactéries et les
champignons. La comparaison entre écosystèmes terrestres et aquatiques porte donc
également sur une comparaison entre organismes hétérotrophes (décomposeurs) d‟un côté et
autotrophes de l‟autre. Selon les données connues quant à l‟homéostasie, une réponse
différente est attendue entre ces deux types d‟organismes : une certaine plasticité des espèces
phytoplanctoniques et une homéostasie plus stricte chez les décomposeurs. L‟influence de la
position dans le réseau trophique a également pu être étudiée, par la présence d‟herbivores
consommateurs de phytoplancton en milieu aquatique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%