Mécanismes réactionnels et chimiosélectivité

Mécanismes réactionnels et
chimiosélectivité

1. Polarité d’une liaison (classe de 1ère S)
•Une liaison entre deux atomes est polarisée si ces
deux atomes ont une différence d’électronégativité.
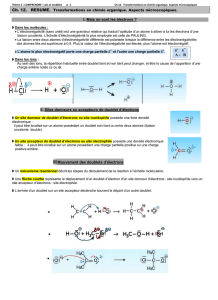
•Les liaisons O–H sont polarisées.
Le doublet n’est pas
équitablement
partagé entre les
atomes
Charge partielle
positive +δ +δ
–2δ
Charge partielle
négative

1. Polarité d’une liaison (classe de 1ère S)
•Un atome est plus électronégatif que celui auquel il
est lié s’il attire vers lui les électrons de la liaison.
•L’atome le plus électronégatif porte une charge
partielle –δ et le moins électronégatif une charge
partielle +δ.
•Autre exemple de liaison polarisée : le chlorure
d’hydrogène HCℓ
H – Cℓ
+δ –δ
atome
électronégativité
H 2,2
Cℓ 3,2

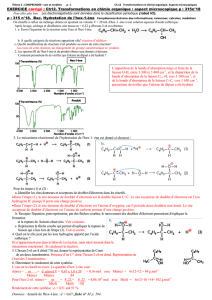
2. Mécanismes réactionnels
•Un mécanisme réactionnel est l’enchaînement
d’étapes qui modélise la réaction au niveau
moléculaire.
•Dans un mécanisme réactionnel, on explique les
ruptures et les formations de liaisons à l’aide de
mouvements de doublets d’électrons.

Mécanisme de la réaction d’estérification
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%