II - Peau et histologie

Par Krys3000 (Groupe « The Trust » - http://www.cours-en-ligne.tk/) Page 1
BIOLOGIE CELLULAIRE
PARTIE II : PEAU ET HISTOLOGIE
CHAPITRE I : LA PEAU
La peau est un tissu (8 % masse corporelle, 1.5 à 2 m², 3 à 5 µg, 1 à 4 mm, 2.10
12
cellules) en trois couches :
Epiderme : couche superficielle protégeant des influences extérieures
Derme : couche avec vaisseaux sanguins et cellules responsables de la défense immunitaire, les organes sensoriels et
les nerfs
Hypoderme : couche constituée de cellules stockant eau et de lipides procurant à la peau son élasticité.
I – FONCTIONS ESSENTIELLES
La peau est d’abord un organe de protection. Elle joue un rôle contre les UV mais également les agressions mécaniques,
chimiques ou thermiques. Elle protège également des micro-organismes, et, de part son caractère relativement imperméable,
protège de la déshydratation.
Egalement, la peau est le moteur de la sensation, avec sa place d’organe sensoriel le plus étendu de l’organisme. Il contient de
nombreux récepteurs pour le toucher, la pression, la douleur et même la température.
Mais chez l’homme surtout, la peau est le principal organe de la thermorégulation. Le corps est protégé de la déperdition
calorique par les cheveux, les poils, et le tissu adipeux. La perte de chaleur est facilitée par l’évaporation de la sueur et régulée
par les vaisseaux.
Enfin, le tissu sous-cutané est une réserve importante d’énergie principalement sous forme de triglycérides. C’est dans la peau
qu’ont lieu beaucoup de fonctions métaboliques comme la synthèse de vitamine D dans l’épiderme.
II – STRUCTURE
A] LE DERME
D’origine mésodermique, cette couche est constituée de couches de collagène et d’élastine. Il y a ensuite une lame basale, de
même origine. On y retrouve également des glandes (sébacées, sudoripares) et les muscles arrecteurs du poil.
B] L’ÉPIDERME
D’origine ectodermique, il est composé de 4 couches :
o Au-delà de la lame basale qui forme les papilles dermiques, siège la couche basale, première couche de l’épiderme,
ordinaire.
o Au dessus, on retrouve la couche épineuse, cellules produisant de la cytokératine reliée par la suite par ponts disulfures
pour donner de la kératine. Ces cellules, plus on avance, plus elles sont gorgées en kératine, perdant leurs noyaux, mais
tenant en place à l’aide des desmosomes.
o Suit la couche granuleuse, ou les cellules, ayant perdu ces desmosomes, se tassent en gros amas cellulaires granuleux.
o Puis la couche cornée ou les cellules sont mortes, et ne sont plus que des blocs de kératine.
C] LES POILS

Par Krys3000 (Groupe « The Trust » - http://www.cours-en-ligne.tk/) Page 2
Se sont des structures de types phanères, prenant source par des papilles dermiques, et dont la lame basale porte le nom de
membrane vitrée. Celle-ci est le seul élément du derme à être d’origine ectodermique.
Le poil est également un assemblage de couches :
- Medulla, couche intérieure
- Cortex, couche extérieure
- Cuticule recouvrant le tout
- Gaine épithéliale (interne puis externe)
- Sac de tissu conjonctif
CHAPITRE II : LES JONCTIONS CELLULAIRES
Avec la 3
ème
genèse, conduisant à l’apparition de la pluricellularité, on est arrivé à la spécialisation des cellules. Celles-ci sont
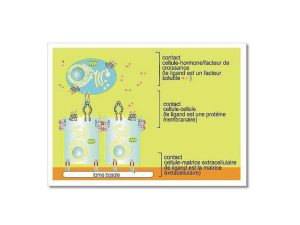
reliées par une matrice extracellulaire, qui agira également en temps que réservoir pour facteurs de croissance et hormones.
Pour fonctionner, les organismes doivent alors avoir une organisation précise des cellules, et des communications entre-elles.
Cette communication se fonde sur l’identification et l’adhésion entre deux cellules homologues.
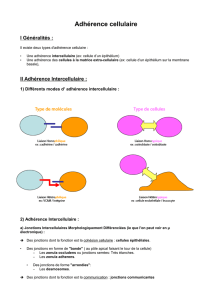
I – TYPES DE JONCTIONS
Une jonction est composée d’un ligand externe et d’un composant cytosolique, reliés par une protéine donc transmembranaire
avec l’aide de molécules de liaison (pour la spécificité notamment).
Il existe différents types de jonctions :
Les jonctions serrées : Ces jonctions scellent les cellules voisines entre elles, et ne laissent aucun espace
intermembranaire, faisant joint pour empêcher l’échange de matériel. Ces jonctions forment une ceinture autour de la
bordure d’un organe ou d’une cavité (intestin, vessie) afin d’empêcher les fuites de fluides. On les retrouve aussi en
« murs » de vaisseaux sanguins.
Ces jonctions sont formées de claudines et d’occludines.
Les jonctions intermédiaires ou adhérentes réunissent les microfilaments d’actine de deux cellules. Les faisceaux de
filaments, qu’on appelle « Terminal Web », communiquent donc en formant une jonction, constituée d’une protéine en
3 domaines (le premier est cytosolique et attaché à l’actine, le deuxième est transmembranaire, et le 3
ème
intercellulaire, relié en dimère pour attacher les cellules l’une à l’autre) : c’est la cadhérine.
Ces molécules s’associent en tête à tête, mais seulement si elles sont dans l’état rigide. Pour cela, elle s’associe à du calcium et
se rigidifie. Il faut que les 5 domaines de liaison au calcium soient occupés pour qu’elle puisse se dimériser par interdigitation
(comme une fermeture éclair) en faisant des liaisons de 30 nm.
Les cadhérines se trouvent en plusieurs types :
- E-cadhérine (cellule épithéliale)
- P-cadhérine (cellule du placenta ou épidermique)
- N-cadhérine (neurone, muscle)
- VE-cadhérine (cellule vasculaire endothéliale)
Les différences entre les cadhérines vont jouer un rôle lorsque les tissus s’organisent. Elles sont attachées à l’actine par des
caténines α et β.
Ces jonctions sont souvent présentent en ceintures également, près des surfaces apicales des cellules. Relâcher ces jonctions
permet parfois d’éviter les AVC.
Les desmosomes sont quelques part similaires, car fonctionnent aussi à la cadhérine, mais elles relient les filaments
intermédiaires. Ils fonctionnent comme un « bouton pression » provoquant une forte adhérence entre deux cellules.
Leur structure est :
o Filaments intermédiaires en coudes reliés à la desmoplakine
o Plaque d’adhésion cellulaire composée de desmogléine et desmocolline. La desmoplakine est attachée à cette
plaque par une autre molécule la composant, la plakoglobine. Cette plaque dense se trouve sur la surface
intérieure de la cellule.
Les desmosomes se retrouvent dans les tissus soumis à des efforts mécaniques (peau, gencives, utérus).

Par Krys3000 (Groupe « The Trust » - http://www.cours-en-ligne.tk/) Page 3
Les hémi-desmosomes ne sont pas des moitiés de desmosomes, bien qu’ils soient asymétriques, avec une seule plaque
d’adhérence. Toutefois, ils sont liés à la matrice et fonctionnent avec des intégrines, plutôt que des cadhérines. On les
retrouve au pôle basal des épithéliums, ou ils fixent ceux-ci à la lame basale en rejoignant les filaments intermédiaires.
Ils sont plus étendus que les desmosomes, leur plaque est plus fine leur conférant une dynamicité qui leur permettra
des désassemblages rapides, lors de la division cellulaire par exemple.
Les jonctions gap (ou nexus) sont des connexions entre deux cellules, symbolisées par une diminution de l’épaisseur de
la membrane à seulement 3 nm. Dans cette zone, des connexines s’organisent en hexamères, donnant un connexon. Il
y a des milliers de connexon par jonctions, un connexon faisant la taille de la membrane. Chaque cellule fournit donc un
connexon, le tout créant un canal intercellulaire. Ces jonctions peuvent se fermer par baisse du pH ou augmentation de
Calcium (afin d’ajuster le degré de couplage des cellules). Elles laissent passer jusqu’à 1.2 nm.
Ce couplage métabolique permet d’échanger des petites molécules entre les cellules et ainsi stimuler des cellules n’ayant pas
forcément reçu directement l’hormone (contraction musculaire, etc.…)
II – CAMS ET PATHOLOGIES ASSOCIÉES
Les molécules d’adhérence cellulaire (intégrines, cadhérines, claudines) servent, en temps normal, à lier les cellules et maintenir
l’intégrité des tissus. Pendant la dédifférenciation, la quantité et la nature des CAMs change, notamment les cadhérines. Cela
arrive aussi en cas de maladies :
- Anticorps auto-immuns attaquant la cadhérine desmogléïne maladie de la peau, la pemphigus vulgaris.
- Mutation de claudine 16 affecte l’écoulement de Mg
2+
dans le rein.
- Mutation de claudine 14 surdité due à l’altération de transport de cellules dans la cochlée.
- Toxines bactériennes Transport paracellulaire accru.
III - ANCRAGE CELLULE-MATRICE PAR LES INTÉGRINES
La cellule est ancrée à la matrice extracellulaire par les intégrines. Celles-ci sont des glycoprotéines qui servent de récepteurs
pour les constituants de la MEC à la surface de la cellule : collagène, laminine, fibronectine.
Il existe des tas de types d’intégrines du fait de leur grande diversité combinatoire :
L’intégrine se compose de 2 sous-unités, α et β, mais il existe 18 α différentes et 8 β différentes, générant au total beaucoup de
combinaisons. C’est le domaine extracellulaire d’α qui décidera de la liaison avec la molécule de la MEC, en reconnaissant les
motifs RGD (Arginine, Glycine, Aspartate). La partie intracellulaire, elle, se lie à la taline, une protéine du cytosquelette qui fait le
lien avec les filaments associés. L’intégrine joue alors le rôle de régulateur des liaisons intégrines/MEC. En effet les intégrines ne
sont pas directement activées et doivent changer de conformation pour pouvoir lier la MEC. Ces changements sont induits par
des cations bivalents, qui activent des récepteurs de signaux. Ces signaux peuvent venir de l’intérieur de la cellule.
Cette influence entre la MEC et le cytosquelette est mutuelle : fibronectine peut engager une réorganisation du cytosquelette,
lui-même pouvant influer sur la structure et l’orientation de la MEC.
La coagulation, sur un site de blessure, est un phénomène due à l’activation d’intégrine αIIbβ3, augmentant, par changement de
conformation du domaine cytoplasmique, l’affinité avec les fibrinogènes du plasma sanguin. Cette induction de la partie externe
sur la partie interne de l’intégrine s’appelle signalisation inside-out.
Les désintégrines sont capables de bloquer la coagulation. Ce sont des protéines du venin de serpent, contenant la séquence
RGD, et agissant comme une sorte d’inhibition compétitive.
Parmi les jonctions, les hémi-desmosomes utilisent l’intégrine, et parfois aussi les jonctions intermédiaires.
IV - ANCRAGE NON-JONCTIONNEL
Il existe également le cas d’ancrage qui n’est pas du aux jonctions.
Les CAMs qui appartiennent à la superfamille des immunoglobulines (IgCAM), transmembranaires, peuvent réguler des
interactions (I-CAM : entre lymphocytes et cellules de la réponse immunitaire ; V-CAM, N-CAM, L1 : entre cellules non-
immunes). Pour les N-CAM, qui servent d’adhérence dans les neurones, on a deux N-CAM de cellules opposées qui
s’assemblent par un site de liaison extracellulaire, via interactions homophiles. Il y a 20 N-CAM différentes, toutes dues
à des différences d’épissage d’un gène unique.

Par Krys3000 (Groupe « The Trust » - http://www.cours-en-ligne.tk/) Page 4
Les sélectines, elles, sont des glycoprotéines qui médient les interactions par des liaisons avec d’autres glycoprotéines,
sur les cellules opposées, de façon calcium-dépendante. On retrouve 3 types de sélectine :
o Sélectine L dans les leucocytes : la plus petite.
o Sélectine E dans l’endothélium, de taille moyenne.
o Sélectine P dans les plaquettes, de grande taille.
Structure de la sélectine :
Prenons le cas du leucocyte pour résumer l’ancrage non-jonctionnel. C’est le système de l’extravasation. Le leucocyte arrive au
contact de la cellule épithéliale, avec, à sa surface, des ligands de sélectine, des intégrine et des récepteurs PAF. La cellule
épithéliale synthétise alors PAF, et « amarrent » la cellule, tout en sécrétant des sélectines. La liaison PAF/récepteur active
l’intégrine, et le leucocyte roule pour se lier à son récepteur, et ainsi, avance progressivement. Il pourra ensuite passer entre
deux cellules.
Des recherches sur la neutralisation des sélectines peuvent mener à empêcher l’invasion des neutrophiles par extravasation, et
ainsi supprimer l’inflammation.
CHAPITRE III : LES MOTEURS MOLÉCULAIRES
I – CILS ET FLAGELLES : DIFFÉRENCES
Elle se trouve au niveau du mouvement de liquide qu’elle va générer : les cils battent afin de former un mouvement de liquide
parallèle à la surface, alors que le flagelle fournira un mouvement perpendiculaire.
On retrouve les cellules ciliées notamment dans les voies respiratoires, ou dans les branchies des bivalves sous forme de tapis,
tous en relations les uns avec les autres à l’aide de jonctions communicantes.
II – STRUCTURE DU CIL
Un cil est constitué :
- D’une racine ciliaire, qui n’est pas forcément présente, servant d’ancrage cytoplasmique
- D’un corpuscule basal ou cinétosome, qui sert de base à deux microtubules centraux, avec neuf triplés de microtubules
périphériques reliés au centre
- D’un axonème, parcouru par ces deux microtubules, et par 9 autres périphériques en doublets, reliés aux centraux.
Vers le centre du cil, il y a une interruption, entre cinétosome et axonème, des microtubules centraux, ne laissant que
les triplets.

Par Krys3000 (Groupe « The Trust » - http://www.cours-en-ligne.tk/) Page 5
Au sein de l’axonème, c’est le microtubule A le plus important du doublet : c’est celui des deux qui porte la fibre rayonnante.
C’est lui aussi qui va porter les MAPs motrices impliquées dans le mouvement.
III – LES MAPS MOTRICES
Il en existe deux familles : Kinésines et Dynéines, qui sont des ATPases spécialisées dans le mouvement des molécules, des
vésicules et des organites. Sur le microtubule il y a deux bras de dynéine, un externe et un interne.
Ces molécules ont deux têtes identiques et une queue, site de fixation du matériel transporté. Même si le mécanisme
moléculaire est compris, le contrôle du sens de déplacement est encore mal connu. Qu’on soit dans le cas kinésine ou dynéine,
le système est le même au niveau du déplacement : le microtubule est composé de tubuline α et β, GTP-liées.
- ETAPE 1 : Une des têtes se lie à l’ATP et se colle à la tubuline β.
- ETAPE 2 : La deuxième tête, ADP-liée, devient ATP-liée, provoquant un pivotement vers la tubuline β suivante à laquelle
elle se lie
- ETAPE 3 : Hydrolyse de l’ATP de la première tête et décollement, puis on recommence.
Le transport se fait ainsi : dynéine du plus vers le moins, kinésine le contraire. Dans le cas du cil ce sont les dynéines qui se
déplacent, interagissant avec la tubuline des microtubules B voisins : il en résulte une courbure du cil puis, lorsque la tête se
décroche, ça redevient droit.
CHAPITRE IV : LA MATRICE EXTRACELLULAIRE
I – PROPRIÉTÉS GÉNÉRALES
L’espace extracellulaire est en partie voire totalement occupée par cette MEC.
Celui-ci est composé de 3 types de molécules
Les édifices fibreux de collagènes ou de fibres élastiques
Les glycoprotéines moins volumineuses mais jouant un rôle dans l’adhérence entre les constituants matriciels et entre
MEC/cellule (fibronectine, laminine)
Les polysaccharides, glycosaminoglycanes et protéoglycanes, qui piègent de l’eau et forment un gel de remplissage, le
ballast.
Ces molécules sont synthétisées par des cellules spécialisées (fibroblastes et dérivés dans la matrice conjonctive) : elles sont
responsables de la biosynthèse et du renouvellement des molécules.
 6
6
 7
7
 8
8
1
/
8
100%