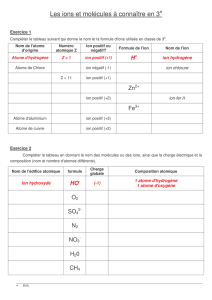
Symboles et formules chimiques

Symboles et formules
chimiques
11 Règles de nomenclature
Noms des composés
Anions et cations monoatomiques
Anions et cations polyatomiques

Pour une molécule:
a) Lire de droite à gauche
b) Préfixes : di = 2 octo = 8
grecs Tri = 3 nona (ennéa) = 9
tétra (tétr-) = 4 déca = 10
penta (pent-) = 5 hendéca = 11
hexa = 6 dodéca = 12
hepta = 7 etc..

Règle 1
Dans le cas où il s’agit d’un
composé ionique, l’ion positif
(cation) est toujours placé en
tête dans l’écriture de la formule.
Ex: NaCl, K2O, CaBr2

Règle 2
Dans le cas d’un composé
bivalent, le constituant à placer
en tête dans l’écriture de la
formule est celui qui figure le
premier dans la liste suivante:
Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H,
Te, Se, S, At, I, Br, Cl, O, F.
(le plus électronégatif à droite)
Ex: XeF2 , NH3 , H2S , Cl2O , OF2

Règle 3
Qu’il s’agisse ou non d’un composé
ionique, l’élément que l’on écrit
en premier dans la formule est
nommé en second sans être
modifié, dans le nom du composé;
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%