UV-Vis

SPECTROMETRIE
DANS L’UV - VISIBLE
Davinia FERNANDEZ
Asim ALTAS

1. Introduction
2. Spectres UV-visible , spectres électroniques
3. Apparaillage
4. Applications
5. Types de bandes d’absorption
6. Technique expérimentale
Sommaire

1. Introduction
2. Spectres UV-visible , spectres électroniques
3. Apparaillage
4. Applications
5. Types de bandes d’absorption
6. Technique expérimentale
1. Introduction
2. Spectres UV-visible , spectres électroniques
3. Apparaillage
4. Applications
5. Types de bandes d’absorption
6. Technique expérimentale

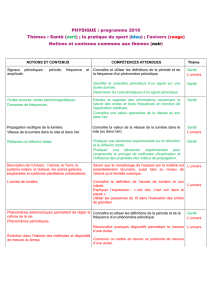
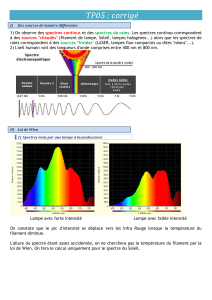
La région ultraviolette s'étend de 10 nm à400 nm mais
les spectromètres UV usuels ne permettent le tracédes
spectres que pour les longueurs d'onde comprises entre
200 nm et 400 nm (proche UV).
La région du visible s'étend de 400 nm à800 nm; cette
gamme de mesure est atteinte avec le même spectromètre
utiliséen UV par la simple commutation de la source.

La couleur est la manifestation de l’absorption de lumière
visible ( λ = 4000 à8000 Å; 400 à800 nm ).
Les substances incolores peuvent absorber dans l’UV (
ultra-violet ) proche ( λ=200 –400 nm )et dans l’IR (
infra-rouge;λ>800 nm ). Toutes les substances
absorbent dans l’UV lointain ( λ<200 nm ), y compris le
quartz, matériau employépour les cellules de mesure
qu’on utilise en spectroscopie UV - visible ( λ=200 -800
nm ).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%