/1 /8 /5 /1 /15 /20 Exercice 1 : Des blattes….et des scarabées.

!"#$%&'()*+,-&'.&/(#'01(&'().23)&4'5,'.)1&(62,&(#'.7#8+(.'9&-'(&9#12+,-'9211)(#9&-'&1'+,':&(#'&,-%21&'9&-'#**92;#12+,-'
,%6)(2$%&-'<#%;%,'*+2,1',&'-&(#'#11(28%)'*+%('9&-';#9;%9-'2,1&(6).2#2(&-=4'!"#$%&'()-%91#1'.+21'01(&'#;;+6*#3,)'.&'
-+,'%,21)'&1'.+,,)'#/&;'%,',+68(&'.&';"2::(&-'-23,2:2;#12:-';+")(&,1'#/&;'9&-'.+,,)&-4''
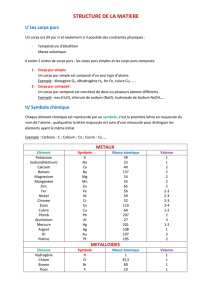
!"#$%&$'()*"#$+$,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,-$
."/0102%($2%2$
3"**40224*3%2$
5)4102%($
6*4172%($
89&(40(%$%&$ %9:1"0&%($
1;0*<"(#4&0"*$
!"&%$
/1#
/8#
/5#
/1#
/15#
/20#
!
!
Mob$
Rea$
Ana$
Ext$
Exercice#1#:#Des#blattes….et#des#scarabées.##=>?@$:"0*&2A#
B%2$:C)("#"*%2$2"*&$D%2$2E/2&4*3%2$3C0#0FE%2$)#02%2$:4($3%(&40*2$4*0#4E9$%&$G)H)&4E9$:"E($
422E(%($14$3"##E*034&0"*$4E$2%0*$D%$1;%2:I3%-$
$
Doc#n°1#:#Blattes#et#phéromones$$
B4$D0#)&C714#0*%$%2&$E*%$:C)("#"*%$FE0$:%(#%&$4E9$/14&&%2$
D%$3"##E*0FE%(-$$ $
$
$
$
$
#
Doc#n°2#:#Scarabées#et#phéromones#$$
$
$
$
B%2$234(4/)%2$
4D":&%*&$E*$G"1$$D)2"(D"**)$
JE2FE;K$3%$FE;012$0D%*&0<0%*&$1;"D%E($
D;E*%$:14*&%$D"*&$012$2%$*"E((022%*&$
"E$E*%$:C)("#"*%$:(":(%$K$1%E($
%2:I3%-$$
$
Doc#n°3#:$!E#)("$4&"#0FE%$D%$FE%1FE%2$)1)#%*&2$
$
81)#%*&$3C0#0FE%$
L7D("HI*%$
M4(/"*%$
6N"&%$
O97HI*%$
!E#)("$4&"#0FE%$
P$
>$
Q$
R$
$
$
1. B%2$:C)("#"*%2$30SD%22E2$2"*&S%11%2$D%2$#"1)3E1%2$"(H4*0FE%2$T$UE2&0<0%(-$
2. UE2&0<0%($:"E($3C4FE%$4&"#%$1%$*"#/(%$D%$10402"*2$%&$D%$D"E/1%&2$*"*$104*&2-$
3. 5%:()2%*&%($14$<"(#E1%$D%$B%V02$D%$14$#"1)3E1%$D%$D0#)&C714#0*%-$
4. W*%$:C)("#"*%$2%9E%11%$D%$234(4/)%$:()2%*&%$E*%$02"#)(0%$X-$M%14$3"((%2:"*DS01$K$14$
#"1)3E1%$P$"E$K$14$#"1)3E1%$Y$T$
5. Z4*2$14$#"1)3E1%$P?$D)&%(#0*%(?$%*$%9:10FE4*&$1%$(402"**%#%*&?$14$H)"#)&(0%$4E&"E($D%$
1;4&"#%$D%$34(/"*%$10)$K$1;"97HI*%$:4($E*%$D"E/1%$10402"*-$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
P$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
P?@$
P$
P$
$
Y$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
Total$
$
$
$
$
$ $
Jeudi#14/11/2013#
#
DEVOIR#SURVEILLE#N°2#
#
1ère#S#
!$
M$
M$

Exercice#2#:#Dosage#de#l’ion#nickel#Ni2+$=>$:"0*&2A$
B%$*03[%1$%2&$E*$#)&41$411%(HI*%?$01$%2&$D):02&)$D4*2$1%2$:4(&0%2$#)&4110FE%2$D%$/0J"E9$K$1;40D%$D%$
[0&2$2:)304E9-$O*$"/&0%*&$E*%$2"1E&0"*$D\0"*$*03[%1$!0Y]$*"&)%$^-$
B4$2"1E&0"*$^$D\0"*$*03[%1$%2&$3"1"()%-$O*$2"EC40&%$14$D"2%($:4($2:%3&(":C"&"#)&(0%-$M;%2&$
:"E(FE"0$"*$3C"020&$D%$3"*2&(E0(%$E*%$3"E(/%$D;)&41"**4H%$K$1;40D%$D%$2"1E&0"*2$4FE%E2%2$
D\0"*2$*03[%1$D%$3"*3%*&(4&0"*2$3"**E%2$&"E&%2$D0<<)(%*&%2-$'"E($3%14?$"*$:4(&$D;E*%$2"1E&0"*$
#I(%$^_$$D%$3"*3%*&(4&0"*$M_$`$Y?@_$9$P_SP$#"1aB-$$
O*$#%2E(%$1;4/2"(/4*3%$D%$D0<<)(%*&%2$2"1E&0"*2-$O*$"/&0%*&$1%$H(4:C0FE%$2E0G4*&$+$
$
Donnée#:##
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
1. 89:10FE%($ 1%$ :("&"3"1%$ %9:)(0#%*&41$ D%$ <4/(034&0"*$ D%$ 14$ 2"1E&0"*$ ^;$ D%$ 14$ 3"E(/%$
D;)&41"**4H%$ %*$ :()3024*&$ 1%$ #4&)(0%1$ E&0102)$ 243C4*&$ FE%$+$ 14$ 2"1E&0"*$ ^;$ D%$$
3"*3%*&(4&0"*$ M\$`$>?Y@$9$P_SY$#"1aB$ %2&$ "/&%*E%$ :4($ D01E&0"*$ D%$ 14$ 2"1E&0"*$ #I(%-$ B%$
<43&%E($D%$D01E&0"*$G4E&$D"*3$b-$
O*$D02:"2%$D%$+$
! :0:%&&%2$J4EH)%2$D%$@?_$#B$c$P_$#B$c$Y_$#B$c$Y@$#B$
! <0"1%2$J4EH)%2$D%$Y_$#B$c$@_$#B$c$P__$#B-$
$
2. 6$:4(&0($D%$2"*$2:%3&(%$D;4/2"(:&0"*?$D)&%(#0*%($14$3"E1%E($D%$14$2"1E&0"*$D;0"*2$*03[%1-$
3. Z)&%(#0*%($14$1"*HE%E($D;"*D%$K$14FE%11%$D"0&$d&(%$()H1)$1%$2:%3&(":C"&"#I&(%-$
4. UE2&0<0%($FE%$14$2"1E&0"*$D;0"*2$*03[%1$G)(0<0%$14$1"0$D%$e%%(SB4#/%(&-$
5. B;4/2"(/4*3%$D%$14$2"1E&0"*$^$D;0"*2$*03[%1$%2&$D%$P?f-$8*$D)DE0(%$24$3"*3%*&(4&0"*-$
Mob$
5%4$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
Y$
$
6*4$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
P$
_?@$
P?@$
P$
Ext$
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
$
Total$
$
$
$
!
$

Exercice#3#:#Couleur#des#hortensias$$=Y?@$:"0*&2A$
M%(&40*%2$ <1%E(2$ 3"##%$ 1%2$ C"(&%*2042$ :"22ID%*&$ D%2$ 3"E1%E(2$ G4(0)%2$ DE%2$ K$ D%2$ :0H#%*&2$
*4&E(%12-$Z4*2$E*$2"1$/420FE%?$1%2$<1%E(2$2"*&$("EH%$<E3C204?$#402$2\01$%2&$430D%?$%11%2$2"*&$/1%E$
:"E(:(%-$
$
B4$ 3"E1%E($ D%2$ C"(&%*2042$=<1%E(2A$ %2&$ DE%$ K$ E*%$ #"1)3E1%$ "(H4*0FE%$ *"##)%$ 374*0D0*%?$ FE0$
:%E&$:(%*D(%$:1E20%E(2$<"(#%2-$$
$
Doc#n°1#:#Formules#développées#de#la#cyanidine#
#
$
$
P- ^E(10H*%($1%2$D"E/1%2$10402"*2$3"*JEHE)%2$D%$3C4FE%$<"(#%$D%$14$#"1)3E1%$D%$374*0D0*%-$
Y- UE2&0<0%($1%$34(43&I(%$0*3"1"(%$D%$14$:(%#0I(%$<"(#%$%&$1%$34(43&I(%$3"1"()$D%$14$
D%E90I#%$<"(#%$D%$14$374*0D0*%-$$
f- Z%$FE%1$:4(4#I&(%$3C0#0FE%$D):%*D$14$3"E1%E($D%$14$374*0D0*%$T$$
$
."/$
5%4$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
_?@$
6*4$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
P$
$
89&$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
$
P$
Total$
$
$
$
!
$
$
$
Données#pour#tous#les#exercices#:#
!
!!!!!!!!!!!!!!!!!!!!!!!!
!
#
#
# #

Correction#du#DS#2#
Exercice#1#
P- B%2$:C)("#"*%2$2"*&$D%2$#"1)3E1%2$"(H4*0FE%2$34($%11%$3"*&0%**%*&$D%2$4&"#%2$D%$34(/"*%$%&$C7D("HI*%-$
Y- B;4&"#%$D;C7D("HI*%$4$:"E($*E#)("$X`P$D"*3$:"E($2&(E3&E(%$)1%3&("*0FE%$g=PA-$h1$1E0$#4*FE%$E*$)1%3&("*$
:"E($24&E(%($24$3"E3C%$%9&%(*%$D"*3$01$G4$D"*3$<"(#%($P$10402"*$=(IH1%$DE$DE%&A-$h1$*;4E(4$:42$D%$D"E/1%&$*"*$
104*&-$
B;4&"#%$D%$34(/"*%$4$:"E($*E#)("$X`>$D"*3$:"E($2&(E3&E(%$)1%3&("*0FE%$g=YAB=bA-$h1$1E0$#4*FE%$b$)1%3&("*2$
:"E($24&E(%($24$3"E3C%$%9&%(*%$D"*3$01$G4$D"*3$<"(#%($b$10402"*2$=(IH1%$D%$1;"3&%&A-$h1$*;4E(4$:42$D%$D"E/1%&$
*"*$104*&-$
B;4&"#%$D;4N"&%$4$:"E($*E#)("$X`Q$D"*3$:"E($2&(E3&E(%$)1%3&("*0FE%$g=YAB=@A-$h1$1E0$#4*FE%$f$)1%3&("*2$:"E($
24&E(%($24$3"E3C%$%9&%(*%$D"*3$01$G4$D"*3$<"(#%($f$10402"*2$=(IH1%$D%$1;"3&%&A-$h1$1E0$(%2&%$41"(2$@Sf`Y$)1%3&("*2$
10/(%$D"*3$P$D"E/1%&$*"*$104*&-$
f- i"(#E1%$D%$1%V02$+$$
$
b- B;02"#I(%$X$%2&$14$#"1)3E1%$P-$
@- 6E&"E($D%$1;4&"#%$D%$34(/"*%$01$7$4$f$4&"#%2$%&$:42$D%$D"E/1%&2$*"*$104*&2-$h12$G"*&$2%$:143%($4E9$2"##%&2$
D;E*$&(04*H1%$D"*3$14$H)"#)&(0%$4E&"E($D%$M$2%(4$&(04*HE140(%$:14*%-$
Exercice#2#:#
P- O*$2"EC40&%$D01E%($:4($b$14$2"1E&0"*$#I(%$^_-$
'("&"3"1%$D%$D01E&0"*$+$
• '()1%G%($K$14$:0:%&&%$J4EH)%$@?_$#B$D%$2"1E&0"*$#I(%$D4*2$E*$/)3C%($D%$2%(G03%-$
• j%(2%($D4*2$E*%$<0"1%$J4EH)%$D%$Y_$#B-$
• 6J"E&%($E*$:%E$D;%4E$D02&011)%-$
• L"#"H)*)02%(-$
• 6J"E&%($D%$1;%4E$D02&011)%$JE2FE;4E$&(40&$D%$J4EH%-$
• L"#"H)*)02%(-$
Y- B4$2"1E&0"*$D;0"*2$!03[%1$4/2"(/%$4E9$41%*&"E(2$D%$b__$*#$%&$Q__$*#$D"*3$G%(2$1%$/1%E$%&$("EH%-$811%$2%(4$
D"*3$GE%$D%$14$3"E1%E($3"#:1)#%*&40(%$1%$G%(&-$
f- B%$2:%3&(":C"&"#I&(%$D"0&$d&(%$()H1)$4E$#490#E#$
D;4/2"(:&0"*$D%$14$2"1E&0"*$D;0"*2$!03[%1$2"0&$b__$*#-$
b- ^E($1%$H(4:C0FE%$6`<=MA$"*$4$D%2$:"0*&2$FE420S410H*)2-$O*$
:%E&$D"*3$#"D)102%($:4($E*%$<"*3&0"*$10*)40(%$3%$FE0$
:("EG%$FE%$6$%&$M$2"*&$:(":"(&0"**%12$=1"0$D%$e%%(S
14#/%(&A-$
@- O*$#"D)102%$1%$H(4:C0FE%$%&$"*$<40&$E*%$1%3&E(%$
H(4:C0FE%$+$M`_-Y@$#"1aB$
Exercice#3#:#
$
P- B4$PI(%$<"(#%$3"*&0%*&$Q$D"E/1%2$10402"*2$3"*JEHE)%2$%&$14$D%E90I#%$R-$
Y- B4$:(%#0I(%$<"(#%$3"*&0%*&$#"0*2$D%$Q$D"E/1%2$10402"*2$3"*JEHE)%2$3"*2)3E&0G%2$D"*3$%11%$0*3"1"(%$
3"*&(40(%#%*&$K$1;4E&(%$<"(#%$FE0$3"*&0%*&$:1E2$D%$Q$D"E/1%2$10402"*2$3"*JEHE)%2$3"*2)3E&0G%2-$
f- B4$3"E1%E($D%$14$374*0D0*%$G4(0%$%*$<"*3&0"*$D%$1;430D0&)$DE$2"1$D"*3$%*$<"*3&0"*$DE$:L-$
$

$
$
$
$
$
$
$
1
/
5
100%