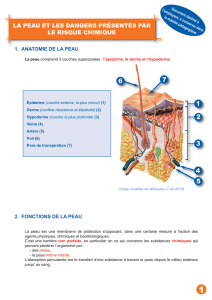
Le vocabulaire en SVT et Physique-Chimie - Les SVT

Le vocabulaire en SVT et Physique-Chimie
Le vocabulaire en SVT et Physique-Chimie
A.
A.
Les transformations physiques - L'eau
Les transformations physiques - L'eau
1. Changements d'état pour une substance donnée
La solidification est le passage de l'état liquide à l'état solide.
La fusion est le passage de l'état solide à l'état liquide.
La vaporisation est le passage de l'état liquide à l'état vapeur (gazeux). Cette vaporisation
peut prendre 2 formes :
- L'ébullition : à température constante sous une pression donnée pour un corps pur
(souvent on doit chauffer, exemple de l'eau à 100°C sous une pression de 1013 hPa).
- L'évaporation : pas de critère fixe de température (exemples : le linge qui sèche, les
marais salants). L'évaporation, limitée par la tension en vapeur saturante, est favorisée
par :
- l'augmentation de surface de contact avec l'air ;
- le vent ;
- une élévation de température.
La liquéfaction est le passage de l'état vapeur (gazeux) à l'état liquide (terme à utiliser de
préférence à condensation qui est aussi utilisé mais dans ce cas parler de condensation à
l'état liquide).
La sublimation est le passage de l'état solide à l'état vapeur (sans passage par l'état
liquide).
La condensation est le passage de l'état vapeur à l'état solide (sans passage par l'état
liquide).
2. Brouillard - Fumée
Brouillard : fines gouttelettes d'une substance liquide en suspension dans un gaz ou un
mélange de gaz. Le plus souvent le terme brouillard s'applique à un brouillard d'eau : petites
gouttelettes d'eau (à l'état liquide) en suspension dans l'air. Lorsque l'on utilise un aérosol
il en sort un brouillard (de la substance contenue dans cet aérosol).
Fumée : fines particules d'une substance solide en suspension dans un gaz ou un mélange de
gaz. Fumées noires issues d'une combustion incomplète : petites particules de carbone en
suspension dans l'air. Quand on tape un tampon qui sert à effacer le tableau (écriture à la
craie) on fabrique une fumée de craie. Les fumées noires qui sortent des cheminées
d'usines sont en général un mélange de brouillard et de fumées.
3. Mélange homogène - Mélange hétérogène
En physique-chimie un mélange est dit hétérogène si on distingue au moins deux de ses
constituants à l'œil nu, sinon il est dit homogène ;
Un liquide homogène peut être un corps pur ou un mélange :
- L'eau du robinet est un mélange, mais pas l'eau pure ;
- Le cyclohexane est un corps pur.
1/3

4. Eau pure - Eau minérale - Eau de source - Eau potable - Eau médicamenteuse
L'eau pure est plutôt un "modèle", elle n'est constituée que de molécules d'eau, on assimile
en général l'eau distillée à de l'eau pure.
Une eau minérale n'est pas une eau pure. Elle contient des sels minéraux et des gaz
dissous. La composition en sels minéraux d'une eau minérale est fixe, ce qui n'est pas
toujours le cas pour une eau de source.
Une eau potable répond à des critères de potabilité, les teneurs des différentes
substances dissoutes ne doivent pas dépasser certains seuils. Au regard de ces seuils,
certaines eaux minérales ne peuvent pas être déclarées potables, dans ce cas elles sont
dites médicamenteuses (ces eaux ne doivent pas être bues sur de longues périodes, sauf
sur avis médical).
5. Dissolution
Une substance (soluté) se dissout dans un liquide (solvant) quand on obtient un mélange
homogène (solution de soluté dans le solvant).
6. Masse - Poids
La masse caractérise une quantité de matière. Pour un objet (une substance) donné elle est
invariable et s'exprime en kilogrammes (kg).
Le poids (sur terre) est la force d'attraction que la terre exerce sur un objet (une
substance). Pour un objet donné il varie légèrement en fonction du lieu (latitude et
altitude), il s'exprime en newton (N).
2/3

B.
B.
Les réactions chimiques
Les réactions chimiques
1. Nom de certaines substances
- Dioxygène et non oxygène ;
- Diazote et non azote ;
- Dioxyde de carbone et non CO2 ou gaz carbonique.
2. Quelques définitions
- Réactif : substance initiale (de départ) d'une réaction chimique.
- Produit : substance finale (d'arrivée) d'une réaction chimique.
- Réaction chimique : au cours d'une réaction chimique le ou les réactifs disparaissent, il se
forme un ou plusieurs produits. Les produits sont différents des réactifs.
- Combustion : action de brûler, elle s'accompagne d'une flamme ou d'une incandescence. Lors
d'une combustion il y a libération d'énergie (réaction exergonique).
- Molécule : une molécule correspond à une association unique d'atomes, l'association prend
en compte la nature des atomes, leur nombre et leur disposition relative dans l'espace.
A un corps pur correspond un type de molécule. L'eau pure n'est constituée que de molécules
d'eau.
3. Quelques points délicats
La "dissolution du calcaire" dans une eau acide n'est pas une dissolution de la substance
chimique calcaire (carbonate de calcium).
La "simplification moléculaire" au cours de la digestion est un ensemble de réactions
chimiques qui permet de décomposer (couper) des grosses molécules (qui ne peuvent passer
à travers la paroi de l'intestin) en molécules plus petites appelées nutriments (qui peuvent
passer à travers la paroi de l'intestin grêle) et qui sont solubles dans le sang et la lymphe.
Les sucs digestifs, en favorisant ces réactions chimiques, jouent un rôle important dans la
digestion.
Exemples : amidon -> glucose ; lipides -> acides gras + glycérol ; protéines -> acides aminés
C.
C.
Les techniques de séparation
Les techniques de séparation
Ce sont des procédés physiques (il n'y a pas modification de la nature chimique des diverses
substances), naturels ou conçus par l'homme, qui permettent de séparer certains constituants
d'un mélange. Les principales techniques de séparation qui peuvent être connues au collège
sont :
- La décantation ;
- La sédimentation ;
- La filtration ;
- La centrifugation ;
- La distillation ;
- La chromatographie ;
3/3
1
/
3
100%