Chapitre IV Les atomes

Chapitre IV Les atomes pour comprendre les transformations chimiques
I] Activité de groupe
Pour expliquer, au niveau des molécules, les transformations chimiques, nous
arrivons à la conclusion suivante :
Les molécules des réactifs se cassent en petites particules appelées atomes,
qui s’arrangent différemment pour former de nouvelles molécules, celles des
produits.
II] Atomes et molécules
Les atomes et les molécules
Pour expliquer, au niveau des molécules, les transformations chimiques, nous
avons conclu que les molécules des réactifs se cassaient en petites particules
appelées atomes.
Ces atomes s’arrangent différemment pour former de nouvelles molécules, celles
des produits.
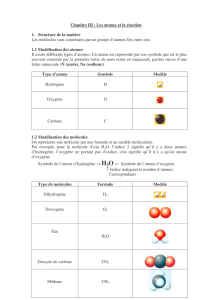
Les atomes
•Il existe environ une centaine d’atomes différents, chacun est modélisé par
des sphères de tailles et de couleurs différentes : le modèle de l’atome de
carbone est , celui de l’atome d’hydrogène est et celui de l’atome
d’oxygène est .
•Chaque atome est représenté par un symbole composé d’une lettre majuscule
ou de 2 lettres, la 1ère en majuscule et la seconde en minuscule. Le symbole de
l’atome de carbone est C , celui de l’atome d’hydrogène est H et celui de
l’atome d’oxygène est O .
Atome Carbone Hydrogène Oxygène
Modèle
Symbole C H O

Les molécules
•Les molécules les plus petites sont constituées de 2 atomes, comme le
dioxygène ou le diazote mais les plus grosses peuvent contenir jusqu’à mille
atomes, comme les protéines.
•Une molécule est modélisée par son modèle moléculaire.
•Une molécule est représentée par sa formule chimique qui regroupe le nombre
et les types d’atomes présents dans la molécule.
Le nombre d’atomes s’écrit en bas à droite du symbole de l’atome.
Attention, le nombre 1 ne s’écrit jamais !
Molécule Dioxygène Eau Dioxyde de
carbone Méthane
Modèle
moléculaire
Formule
chimique O2H2O CO2CH4
Atomes
présents
dans la
molécule
2 atomes
d’oxygène
2 atomes
d’hydrogène et
1 atome
d’oxygène
1 atome de
carbone et 2
atomes
d’oxygène
1 atome de
carbone et 4
atomes
d’hydrogène
Questions
1) La molécule de butane est constituée de 4 atomes de carbone et de 10 atomes
d’hydrogène. Quelle est sa formule chimique ?
Sa formule chimique est C4H10.
2) La formule chimique du glucose est C6H12O6. Quels sont les noms et les
nombres des différents atomes présents dans la molécule de glucose ?
Une molécule de glucose est constituée de 6 atomes de carbone, 12 atomes
d’hydrogène et 6 atomes d’oxygène.

III] Conservation de la masse lors d’une transformation chimique
TP n°3 : La masse varie-t-elle lors d’une transformation chimique ?
Expériences
M réactifs = 144 g
M produits =
Observations et conclusion
La masse ne varie pas lors de la transformation chimique entre la craie et l’acide
chlorhydrique.
Cela s’explique par la conservation des atomes au cours de cette transformation
chimique.
Au cours de toutes les transformations chimiques, la masse des réactifs
disparus est égale à la masse des produits formés.
Les molécules des produits sont constituées des mêmes atomes
que les molécules des réactifs.
144g
Acide
chlorhydrique
Craie
Balance
Dioxyde de carbone
144g

IV] Equation chimique de la combustion du carbone
Transformation
chimique
Réactifs :
Le carbone et le dioxygène
Produits :
Le dioxyde de carbone
Réaction chimique
Carbone + dioxygène dioxyde de carbone
Formules des
espèces chimiques C O2CO2
Modèles des
espèces chimiques
Nombre et nature
des atomes
1 atome de carbone
et 2 atomes d’oxygène
1 atome de carbone
et 2 atomes d’oxygène
Equation chimique C + O2 CO2
L’équation chimique de la combustion du carbone se lit : « Un atome de carbone
et une molécule de dioxygène réagissent pour former une molécule de dioxyde de
carbone ».
Dans toutes les équations chimiques, il y a le même nombre et le même type
d’atomes dans les molécules de réactifs et celles des produits.
Cette équation nous apprend aussi qu’il y a toujours autant d’atomes de carbone
que de molécules de dioxygène qui réagissent ensemble.
Ex : Un million de molécules de dioxygène réagiront avec un million d’atomes de
carbone.

V] Equation chimique de la combustion du méthane
L’équation chimique de la combustion du méthane se lit : « Une molécule de
méthane et deux molécules de dioxygène réagissent pour former deux molécules
d’eau et une molécule de dioxyde de carbone».
Le début de l’équation CH4 + 2 O2 nous apprend aussi qu’il y a toujours deux fois
plus de molécules de dioxygène que de méthane qui réagissent ensemble.
De même la fin de l’équation 2H2O + CO2 nous apprend qu’il se formera toujours
deux fois plus de molécules d’eau que de dioxyde de carbone.
Ex : Un million de molécules de méthane réagiront avec deux millions de
molécules de dioxygène. Il se formera alors un million de molécules de dioxyde
de carbone et deux millions de molécules d’eau.
Transformation
chimique
Réactifs :
Le méthane et le dioxygène
Produits :
L’eau et le dioxyde de carbone
Réaction
chimique méthane + dioxygène eau + dioxyde de carbone
Formules des
espèces
chimiques
CH4O2H2O CO2
Modèles des
espèces
chimiques
Problème Il n’y a pas le même nombre d’atomes
dans les molécules des réactifs et des produits
Représentation
de la
réaction chimique
à l’aide des
modèles
+ +
Nombre et
nature
des atomes
1 atome de carbone
4 atomes d’hydrogène
4 atomes d’oxygène
1 atome de carbone
4 atomes d’hydrogène
4 atomes d’oxygène
Equation
chimique CH4 + 2 O2 2 H2O + CO2
 6
6
 7
7
 8
8
1
/
8
100%