Travaux Pratique Chimie Organique Semestre d`hiver 1997

Travaux Pratique
Chimie Organique
Semestre d’hiver 1997-98
Mars 1998 Julien Hutin

I. Introduction :
Nous allons synthétiser le dibromo-1,4-diméthyl-2,5-benzène à partir de p-xylène. Cette
synthèse sera effectuée par une bromation.
◊ Schéma de la réaction :
II. Théorie :
◊ Questions théoriques :
Synthèse du α,α’-dibromo-p-xylène à partir de p-xylène :
Noms courants du produit : α,α‘-dibromo-p-xylène (= α,α‘-dibrom-p-xylol )
p- Xylylene-dibromide
1,4 bis(bromomethyl)benzène
Référence : Beilstein, 5/2, IV, p. 970
→ Wenner J. , J. Organic Chemistry, 1952, vol.17, pp. 523-527
On obtient notre produit en mettant à reflux du p-xylène avec du NBS (N-Bromo-
Succinimide) dans CCl4 (Tetrachlormethan) comme solvant et un peu de peroxyde de dibenzoyle
[(C6H5CO)2O2] comme initiateur radicalaire de la réaction. Le rendement de cette synthèse est de
60% et plus donc bon. Le produit secondaire principal est le produit monobromé, c’est-à-dire α-
bromo-p-xylène.
Le mécanisme de la réaction est un mécanisme radicalaire et nous avons à faire ici à un
aromatique disubstitué. L’attaque radicalaire se fait donc non sur le cycle mais sur le carbone en
alpha. Ceci s’explique si on regarde une table des réactivités respectives du brome par rapport à
différents carbones :
MeCH2
− H Me2CH
− H Me3C −
H PhCH2 −
H
Br ⋅ 1 220 19’400 64’000
Vu que les hydrogènes aromatiques peuvent être assimilés à des hydrogènes tertiaires ou
secondaires, ils ont donc une réactivité de 220-19’400 et vu la grande sélectivité du brome, on
peut dire que l’hydrogène aliphatique en α a beaucoup plus de chance d’être arraché par le
radical. Il existe toutefois quelques anomalies. Le carbone en alpha est l’hydrogène le plus
souvent attaqué par un radical car le noyau aromatique stabilise efficacement le radical formé
après arrachement de l’hydrogène en α. De plus les radicaux halogénés, vu leur grande
électronégativité, sont des radicaux électrophiles, c’est-à-dire des radicaux qui attaqueront plus
Br
Br
Br2/Fe
CHCl3

vigoureusement des hydrogènes riches en électrons donc situés près d’une double liaison ou d’un
noyau aromatique.
◊ Mécanisme :
Le p-xylène ne réagit pas directement avec le brome ou le fer, mais il réagit avec FeBr3,
une molécule provenant d’une oxydoréduction entre le brome et le fer :
E0
Br2 → Br - + 1.087
Fe → Fe 3+ + 0.036
3/2 Br2 + Fe → FeBr3
Pour la première bromation, les groupes méthyles n’ont pas d’effet orienteur sur le cycle
benzénique car, où que la molécule de brome attaque, on obtient le même produit.
Pourquoi le carbocation n’est-il pas attaqué par Br – ou FeBr4-, c’est-à-dire l’addition d’une
des deux espèces en ortho par rapport au premier brome n’est pas réalisée principalement parce
que la régénération de l’aromaticité du cycle est la force motrice thermodynamique de la
réaction. S’il y a addition, il y a la perte de l’aromaticité. C’est donc énergétiquement moins
favorable.
Pour la seconde bromation, l’effet électroattracteur du brome explique le fait que le second
brome attaque en para par rapport au premier brome. Le carbone en para est le carbone du cycle
dont la densité électronique est la plus faible, donc le plus électropositif. Le produit en para est
aussi plus stable que le produit d’une attaque en ortho, car son dipôle est nul. A part cela, le
mécanisme est identique à celui de la première bromation.
Br Br FeBr3
+BrH+FeBr3+Br
Br
Br Br
::
..
.. .... +FeBr3Br Br FeBr3Br Br FeBr3
δ+ δ− δ+ δ−
Br Br FeBr3
δ+ δ−
+Br
H
+
+FeBr4-
Br
HBr FeBr3
:..
..
+
+
HBr +FeBr3+Br

Pourquoi n’y a-t-il pas de troisième bromation ? La réponse est principalement stérique, le
groupe méthyle et le brome sont trop gros et empêche un autre gros atome de brome d’accéder
aux autres carbones du cycle.
◊ Mode opératoire :
Dans un ballon à trois cols, muni d’un réfrigérant, d’une ampoule à addition et d’un
agitateur magnétique, nous versons 5,2 g de p-xylène, 0,2 g de fer et 50 ml de chloroforme. La
sortie du réfrigérant est connectée à un flacon laveur qui est connecté à un autre flacon laveur
rempli d’eau. Le mélange est chauffé à reflux (80°C), puis on ajoute goutte à goutte le brome
grâce à une ampoule à addition (durée 20 min.).
Le début de la réaction est marqué par un dégagement d’HBr qui se remarque par des
bulles qui s’échappent dans l’eau du second flacon et par le fait que celle-ci est acide. La
solution est alors portée à reflux pendant deux heures.
Ensuite, on laisse la solution refroidir, et, à ce moment, l’eau contenue dans le second
flacon laveur passe dans le premier. On transfère la solution dans une ampoule à décantation et
on la lave successivement avec 20ml d’eau, 20 ml de NaOH à 10%, 20 ml de NaHSO3 à 5%.
Finalement, on lave la phase organique avec trois portions de 10 ml d’eau et on sèche la
phase organique sur CaCl2 et on évapore le solvant. Les cristaux obtenus sont recristallisés avec
10 ml d’hexane, puis ils sont séchés sous vide avec le dessiccateur.
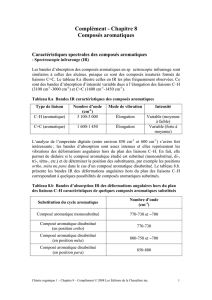
♦ Spectre Infrarouge :
En comparant notre spectre avec le spectre de référence, on peut tout de suite remarquer
qu’ils se ressemblent énormément. Nous avons les principaux pics ; les pics consécutifs aux
alentours de 2925 ppm, représentent les groupes méthyles liés au benzène, ils le sont aussi dans
le pic à 1347 ppm. Le cycle aromatique est exprimé par le pic à 1478 ppm, les doubles liaisons
de celui-ci le sont à 1195 et 1055 ppm. Les pics à 986 et 876 ppm montrent l’existence
d’hydrogène sur le cycle benzénique. A première vue, nous avons obtenu le bon produit.
♦ Spectre RMN :
Notre spectre contient les deux pics singulets du dibromo-2,5-p-xylène ; celui de 2,33 ppm
qui représente les 6 hydrogènes des méthyles et celui de 7,39 ppm pour les deux hydrogènes du
cycle aromatique. Nous avons une impureté ; un pic singulet à 7,26 ppm, c’est le chloroforme, le
solvant de notre expérience. Les surfaces d’intégration concordent, notre produit est bien le
dibromo-2,5-p-xylène et il est assez pur.
♦ Rendement :
Nous avons obtenu 3 g de dibromo-1,4-diméthyl-2,5-benzène (MM 264 g/mol, 11,3
mmol), ce qui nous fait un rendement de 23%.
C’est un assez bon résultat, car nous avons perdu au moins la moitié du produit lors de
l’extraction, une des ampoules a été malencontreusement ouverte.

III. Annexes :
¾ Feuille de toxicité.
¾ Spectre infrarouge du dibromo-1,4-diméthyl-2,5-benzène avec spectre de référence.
¾ Spectre RMN du dibromo-1,4-diméthyl-2,5-benzène.
IV. Bibliographie :
¾ Catalogue Fluka, édition 1996/97
¾ Index Merck, édition 1996 Aldrich Library of IR Spectra
¾ Handbook
¾ Advanced Organic Chemistry, March J., pp. 679-689, 1990, 4th edition
¾ Traité de Chimie Organique, Vollhardt, Schore, 2ème édition, DeBoeck Université,
p.573-576, 1995
1
/
5
100%