A savoir absolument SUP

THERMODYNAMIQUE
Pression
1. Relation force-pression-surface. Unité légale de la pression
2. Montrer l ‘équation de la statique des fluides. Préciser le sens de l’axe vertical.
3. Intégrer l’équation de la statique des fluides à masse volumique constante. Calculer la pression au fond d’un bassin
de 10 m d’eau.
4. Intégrer l’équation de la statique des fluides pour le gaz parfait dans un modèle isotherme. Calculer la pression en
haut du Mont-Blanc (environ 5000m, on choisira 10°C)
5. A quelle hauteur de mercure correspond 1 bar de pression ? Le vérifier par le calcul et dessiner le principe du
baromètre.
6. Que représente physiquement la poussée d’Archimède ? La calculer pour un cube de côté 10 cm de densité 2,5
totalement immergé dans l’eau.
Gaz Parfait
7. Définition du gaz parfait . Equation d’état du gaz parfait
8. Expression de la pression cinétique en fonction de la vitesse quadratique moyenne
9. Energie cinétique d’un atome de gaz parfait, d’une molécule diatomique de gaz parfait (idem pour 1 mole)
10. Expression de la vitesse quadratique moyenne pour un gaz parfait . Préciser les paramètres .
11. Exprimer la masse volumique d’un gaz parfait en fonction de p et T
12. Relier la pression partielle dans un mélange de GP à la pression totale
13. Définir la densité d’un gaz quelconque. Comment se transforme cette définition dans le cas de gaz parfait ? Calcul
de la masse molaire de l’air.
Divers
14. Relier R constante de Joule et k constante de Boltzmann
15. Définition du coefficient χT de compressibilité isotherme. Unité. Calcul pour le gaz parfait.
16. Définition d’une transformation réversible
17. Définition du diagramme de Clapeyron. Tracé d’une adiabatique et d’une isotherme de GP partant d’un même
point du diagramme.
18. Signification de « extensif », « intensif » ; exemples de variables extensive et intensive.
19. Signification de variable « d’état ». Exemple d’une variable d’état et d’une qui ne l’est pas.
20. Le modèle de Van der Waals conduit à l’équation d’état : (p+n2a/V2)(V-nb)=nRT. Quelle est la base de ce modèle ?
Que représente physiquement b ? A quoi est lié le terme n2a/V2 ?
Energie
21. Travail des forces de pression extérieure
22. Travail des forces de pression lors d’une admission d’un volume V de gaz sous la pression constante p1
23. Travail des forces de pression lors d’un refoulement d’un volume V de gaz sous la pression constante p1
24. Travail élémentaire échangé par le gaz lors d’une transformation réversible.
25. Comment déduire graphiquement le travail échangé par le gaz sur le diagramme de Clapeyron ? Signe du travail
lors d’une compression , lors d’une détente.
26. Travail lors d’une transformation isotherme réversible d’une mole de GP en fonction de la température, des
pressions finale et initiale.
27. Premier principe généralisé (ç-à-d avec écoulement envisageable). Premier principe simplifié (ç-à-d sans
écoulement ou déplacement macroscopique du fluide)
28. Que représente l’énergie interne pour un gaz réel puis pour le cas particulier du GP ?
29. Expression de dU dans le cas du GP quelle que soit la transformation envisagée.

30. Le travail des forces de frottement modélisées par une force mécanique macroscopique doit-il être pris en compte
dans W lors de l’application du premier principe ? Où apparaît implicitement ce travail ?
31. Définition d’une transformation adiabatique. « Adiabatique » implique t-il « Isotherme » ? Justifier la réponse.
32. Travail lors d’une transformation adiabatique réversible d’une mole de GP en fonction des températures initiale et
finale.
33. Définition de l’enthalpie. Préciser ce que devient le premier principe simplifié dans le cas d’une isochore, d’une
isobare en utilisant U ou H. A quel type de transformation utilise t-on préférentiellement ΔH à ΔU ?
34. Définition des coefficients calorimétriques molaires à volume constant cVm, à pression constante cpm (avec des
dérivées partielles). Signification physique de ces coefficients.
35. Relation de Mayer (ç-àd relation entre les coefficients calorimétriques pour le GP). Définition de γ. Expression de
cVm et de cpm en fonction de R et de γ pour le GP.
36. Equation de l’adiabatique réversible d’un GP en variable p et V. A partir de quelles relations la démontre t-on ? La
déduire en variable p et T.
37. Expression de dU, dH d’une phase condensée. Que peut-on dire de cVm et cpm pour une phase condensée ?
Pourquoi ?
38. Définition du rendement d’un cycle moteur. Sens du cycle moteur dans le diagramme de Clapeyron.
39. Tracer une isotherme dans le diagramme p(V) d’un corps pur biphasé liquide-vapeur en précisant les zones de
chaque phase ou de mélange. Situer le point particulier critique C. Le passage de liquide à vapeur à température
constante est monovariant : qu’est-ce que cela signifie ? Donner la température d’ébullition Te de l’eau sous 1 bar
de pression. La température d’ébullition de l’eau sous pression de 2 bars est-elle supérieure ou inférieure à Te?
Situer ces deux isothermes dans le diagramme p(V). Préciser la relation d’inégalité entre pression de vapeur sèche
et pression de vapeur saturante à T donnée. Les situer sur le diagramme.
40. Définir la chaleur latente massique L de changement d’état. Par convention elle est positive ; donner la variation
d’enthalpie de 2 kg d’eau lors de sa condensation sous pression constante.
41. Tracer le diagramme p(T) d’un corps pur sous ses trois phases. Préciser les états dans les différentes zones.
Entropie
42. Enoncer le second principe . Donner l’expression de l’entropie échangée en précisant de quelle température il
s’agit. Quelle particularité a l’entropie créée ?
43. Expressions de dS (l’une reliée à dU et l’autre reliée à dH).
44. Variation d’entropie d’un thermostat de température T0.
45. Variation d’entropie d’une phase condensée.
46. Variation d’entropie d’un GP
47. Variation d’entropie lors d’un changement d’état.
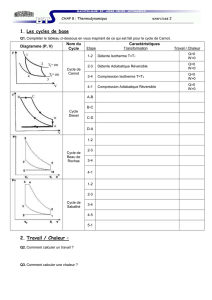
48. Tracer le cycle de Carnot. Donner le rendement du cycle de Carnot réversible. Le redémontrer.
49. Représenter le schéma de principe de fonctionnement d’une machine ditherme de type réfrigérateur avec les sens
réels d’échanges énergétiques. On précisera ce que sont les deux sources de chaleur dans la réalité. Redémontrer la
formule de l’efficacité en fonction des températures des deux sources.
50. Représenter le schéma de principe de fonctionnement d’une machine ditherme de type pompe à chaleur avec les
sens réels d’échanges énergétiques. On précisera ce que sont les deux sources de chaleur dans la réalité.
Redémontrer la formule de l’efficacité en fonction des températures des deux sources.
1
/
2
100%