Thérapie génique : Recherche d`alternatives aux injections d`insuline

30
Orientations futures
Bien que le diabète de type 1 qui est
rapidement fatal en l'absence de traitement
de substitution à l'insuline soit de plus en
plus fréquent, la plupart des personnes qui
ont le diabète sont atteintes du type 2 et ne
requièrent donc pas d'injections d'insuline
pour survivre. Néanmoins, au fil des ans,
leur organisme perd inexorablement sa
capacité à sécréter de l'insuline si bien qu'à
leur tour ces personnes doivent finalement
recourir à l'insulinothérapie.
De nouvelles méthodes pour
administrer de l'insuline
Récemment, des préparations d'insuline ont
été conçues génétiquement afin d'être
absorbées plus rapidement dans le flux
sanguin après une injection sous-cutanée.
Certains types d'insuline modifiés pour
offrir une plus grande stabilité durant 24
heures deviennent disponibles.Toutefois,
l'absorption de cette substance par le corps
après une injection sous-cutanée est
intrinsèquement très variable et il est peu
probable que l'on puisse un jour arriver de
cette façon à des taux d'insuline de base
constants entre les repas et durant la nuit
semblables à ceux observés chez les
personnes non atteintes de diabète. En effet,
les injections d'insuline sous-cutanées ont
d'ailleurs été décrites de façon mémorable
par Sir George Alberti comme étant
"l'insuline non appropriée au mauvais
endroit et au mauvais moment".
Thérapie génique :
Recherche d'alternatives aux
injections d'insuline
Les diabètes de type 1 et de type 2 augmentent
sensiblement le risque de décès des suites d'une
maladie cardiaque et représentent la première cause
de cécité, d'amputation de membre inférieur et
d'insuffisance rénale. Il est aujourd'hui prouvé que ces
complications chroniques du diabète peuvent être
prévenues par un contrôle optimal de la glycémie.
Cependant, atteindre cet objectif au moyen de
l'insulinothérapie conventionnelle occasionne trois fois
plus de crises d'hypoglycémie invalidantes. De plus, un
contrôle glycémique optimal n'est très souvent possible
qu'au prix d'efforts considérables et soutenus de la
part de l'individu concerné et d'une contribution
intensive des services de santé. Dans le domaine en
évolution constante de la thérapie génique, les
alternatives aux injections d'insuline sont
continuellement développées et évaluées.
>>
James Shaw
Avril 2002 Volume 47 Numéro 1

31
Les pompes externes ou implantées
peuvent fournir de l'insuline à un taux
constant et sont munies d'un dispositif
capable d'augmenter la dose au moment
des repas. Cependant, l'achat et
l'entretien de ce type d'appareil sont
coûteux. L'usage de ces pompes ne s'est
généralisé pour le moment qu'aux Etats-
Unis et dans certains pays d'Europe.
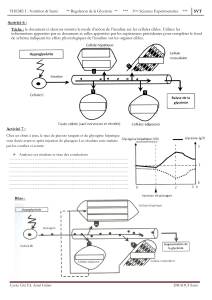
Transplantation
Le pancréas humain
L'insuline est synthétisée et sécrétée par
les cellules bêta des îlots de Langerhans
dans le pancréas, une glande située
derrière la partie inférieure de l'estomac.
La greffe de pancréas entiers provenant
de donneurs humains décédés pourrait
offrir un remède réel au diabète étant
donné que le patient greffé retrouve un
taux d'insuline normal. Cependant, outre
l'intervention chirurgicale majeure qu'elle
nécessite, pouvant entraîner des
complications, cette procédure impose
au patient la prise d'immunosuppresseurs
à vie. Ces médicaments sont en effet
nécessaires pour bloquer la résistance
naturelle de l'organisme face aux
substances étrangères et par conséquent
éviter le rejet de la greffe. Par ailleurs, les
donneurs sont rares. La greffe du
pancréas a pour cette raison été limitée
en grande partie aux personnes
également en attente d'une
transplantation de rein.
Les îlots humains
Plus récemment, suite à l'isolement, la
purification et la greffe des cellules bêta
issues de pancréas humains, un petit
groupe d'individus atteints de diabète de
type 1, traités à Edmonton au Canada, est
parvenu à s'affranchir des injections
d'insuline et à conserver des taux de
glycémie normaux durant deux ans.
L'intervention chirurgicale invasive est
remplacée par une injection de cellules
bêta guidée par les rayons X à travers la
peau et le foie dans la veine porte. Cette
veine assure le transport du sang du
pancréas et de l'intestin vers le foie (voir
figure ci-dessous). Nous attendons avec
impatience les résultats à plus long terme
de cette méthode qui confirmeraient
d'une part l'indépendance continue des
patients vis-à-vis du traitement à l'insuline
et d'autre part la sécurité des nouveaux
immunosuppresseurs utilisés dans cette
approche. Chaque patient d'Edmonton a
eu besoin du pancréas d'au moins deux
donneurs. La généralisation de la greffe
de pancréas entiers et d'îlots isolés
dépendra dès lors de la disponibilité
restreinte de tissus donneurs.
Les îlots provenant de cochons
L'utilisation de tissus pancréatiques
prélevés chez des cochons est complexe
en raison du risque possible de
transmission des infections virales
porcines plus nocives pour l'être humain,
mais aussi de la réponse immune
agressive due à la présence de tissus
étrangers provenant d'une autre espèce.
Ce dernier problème a donné lieu à des
tentatives de clonage de cochons
génétiquement modifiés dépourvus des
gènes responsables du rejet.
Génie génétique
Les cellules de rongeurs
La production en laboratoire des cellules
bêta suivie d'un stockage dans des
banques de tissus en vue des greffes
ultérieures pourrait résoudre le
problème de la disponibilité réduite des
tissus pour la transplantation. Chez les
souris, des résultats positifs ont été
obtenus par irradiation ou par
production génétique de cellules bêta.
D'autres modifications sont nécessaires
pour désactiver les gènes responsables
de la production de l'insuline chez la
souris, en les remplaçant par les gènes
de synthèse de l'insuline humaine. Il est
aussi indispensable d'apporter des
changements nécessaires pour prévenir
la libération accrue de l'insuline à des
taux de glycémie bas. Ce phénomène est
particulier à ces cellules et peut
engendrer des hypoglycémies
dangereuses après transplantation.
Cellules humaines
Avant les travaux menés récemment à
partir de tissus prélevés chez un
enfant atteint d'une condition rare, la
Donneur Receveur
Ilot dans le pancréas Ilot dans la veine porte
Pancréas
Isolement de l'îlot
Seringue
Cellule bêta
Pancréas
Veine porte
Ilot de Langerhans
isolé
Cellules conçues
génétiquement
pour la
transplantation
Les îlots d'origine humaine
ou animale et les cellules
insulino-secrétantes conçues
génétiquement peuvent être
injectés directement dans la
veine porte, ce qui rend
l'intervention moins invasive.
Avril 2002 Volume 47 Numéro 1
Orientations futures

32
production de cellules bêta humaines
en laboratoire était impossible. Les
tissus en question sécrétaient
invariablement une quantité élevée
d'insuline indépendamment du taux
glycémique. Cette condition résulte de
la mutation du gène codant pour une
protéine connue sous le nom de
'récepteur aux sulfonylurées', qui,
couplée à l'action du canal potassique
au niveau des membranes cellulaires
des îlots de Langerhans, joue un rôle
important dans la régulation de la
sécrétion de l'insuline. Le
remplacement de ce gène défectueux,
ainsi que d'un gène du canal potassique
et d'un autre, appelé PDX-1, régulant
la production de l'insuline, permit
d'obtenir une ligne de cellules bêta
pouvant être cultivées en laboratoire
et capables de sécréter de l'insuline en
fonction des fluctuations glycémiques.
Cette lignée de cellules bêta doit
encore faire l'objet de tests sur des
animaux atteints de diabète.Avant de
pouvoir déterminer la faisabilité de
cette approche en tant que thérapie
génique pour le diabète, il faudra
également élaborer un mécanisme
arrêtant la prolifération des cellules
bêta après implantation.
D'autres groupes de chercheurs
examinent la possibilité d'induire la
formation du tissu pancréatique à
partir de cellules souches
embryonnaires. Les cellules souches
sont des cellules immatures capables
de se différencier en plusieurs types
de cellules spécialisées. Les cellules
bêta ont pu être obtenues avec succès
en cultivant des cellules souches
embryonnaires de souris dans des
conditions appropriées en présence
d'un cocktail spécifique de facteurs de
croissance. Ces cellules synthétisent de
l'insuline et, plus intéressant, elles se
sont montrées capables de contrôler
de façon optimale la glycémie après
implantation chez des souris atteintes
de diabète. Cependant, ce travail
demeure à un stade formateur. D'autre
part, les préoccupations d'ordre
éthique persistent autour de
l'utilisation de tissus embryonnaires
humains dans le cadre de la thérapie
génique.
Des travaux récents ont démontré
que les cellules bêta possèdent une
capacité de régénération plus grande
que prévue. Leur taux de
renouvellement est relativement élevé
dans le cas de personnes et d'animaux
non atteints de diabète. On voit
d'ailleurs se développer chez ces sujets
de nouveaux îlots au niveau des
canaux dans les régions du pancréas
jouant un rôle dans la sécrétion de
sucs digestifs dans l'intestin. Cette
capacité a été exploitée en laboratoire
pour produire de nouveaux îlots à
partir de tissus pancréatiques prélevés
chez des rongeurs, des cochons et des
êtres humains. Nous espérons que
cette découverte permettra
d'augmenter considérablement le
nombre d'îlots provenant d'organes de
donneurs afin de résoudre quelque
peu le problème de la disponibilité des
tissus adéquats pour la transplantation.
Prévention des rejets
Le rejet d'une greffe se produit lorsque
les globules blancs, qui luttent contre
l'infection, détectent une protéine
étrangère à la surface des cellules.
Toutes les approches nécessitant la
greffe de tissus étrangers impliquent
l'utilisation permanente d’immuno-
suppresseurs afin de ne pas déclencher
une attaque des globules blancs. Nous
espérions que le rejet pouvait être
évité sans devoir recourir aux
médicaments en enveloppant les
cellules greffées d'une matière
synthétique munie de pores
suffisamment larges pour laisser entrer
l'oxygène et le glucose et laisser sortir
l'insuline, mais suffisamment étroits
pour empêcher toute attaque des
anticorps, les protéines produites par
l'organisme afin de se protéger contre
les substances étrangères. Divers
polymères ont été utilisés en vue de
constituer des micro-capsules
(enveloppant chaque îlot) ou des macro-
capsules (enveloppant un agglomérat de
cellules). Cependant, ces capsules ont
tendance à se rompre et les pores à
s'obstruer du fait des cellules
environnantes. Il convient également de
signaler que les protéines étrangères
s'échappent toujours des capsules,
Approches pour obtenir génétiquement des nouvelles cellules bêta
♦Modification génétique des cellules bêta prélevées chez des enfants atteints des syndromes d'hyperproduction
d'insuline (hyperinsulinisme).
♦Culture de cellules souches embryonnaires dans un cocktail de facteurs de croissance afin de les transformer en
cellules bêta.
♦Culture de cellules souches provenant de canaux pancréatiques qui ont la capacité de se transformer en cellules
bêta dans les conditions adéquates.
Avril 2002 Volume 47 Numéro 1
Orientations futures

33
entraînant une réponse immune.
D'autre part, de plus petites
molécules appelées cytokines
parviennent toujours à s'immiscer
dans la capsule, ce qui provoque un
rejet du tissu greffé à l'intérieur de
celle-ci.
La greffe d'un pancréas artificiel
constitue une approche alternative. Il
s'agit d'une structure en plastique
comportant un ensemble d'îlots
pancréatiques connecté aux
principaux vaisseaux sanguins au
moyen de tubes en vue d'assurer son
propre approvisionnement en sang.
Ce dispositif a déjà été testé chez
des chiens, mais ces derniers
développèrent des complications,
notamment des hémorragies internes
et des thromboses graves. Suite à ces
complications, on a tenté de produire
génétiquement les cellules greffées
afin d'empêcher une attaque du
système immunitaire. Ces approches
"immunomodulatrices" consistent
notamment en : une altération des
protéines produites par les cellules
transplantées dans le but de les
rendre moins "étrangères" ; la
production de cytokines protectrices
pour contrecarrer la réponse
immune ; et l'expression de facteurs
empêchant les cytokines du receveur
d'attaquer la greffe. Ces techniques
n'en sont encore qu'à un stade de
développement peu avancé. Celles-ci
offrent une protection aux cellules
greffées, mais aussi ultérieurement
aux cellules bêta propres aux
patients contre toute attaque du
système immunitaire, empêchant
ainsi la réapparition du diabète de
type 1.
La thérapie génique utilisant
les cellules des patients
Certains pensent que les approches
nécessitant une transplantation de
tissus étrangers continueront à être
affreusement onéreuses, même si le
rejet de la greffe et la réapparition du
diabète traité, qui annule l'action des
nouvelles cellules bêta, peuvent être
évités. L'option de la transplantation ne
sera donc vraisemblablement pas viable
pour la majorité des personnes atteintes
de diabète de type 1 partout dans le
monde.
Les cellules musculaires
Mon groupe de scientifiques ainsi que
d'autres ont démontré sur la base de
recherches menées sur des rongeurs que
les muscles, tels que ceux des jambes,
peuvent absorber et activer de nouveaux
gènes après une simple injection d'ADN :
le constituant des gènes (voir photo). Le
muscle peut être facilement atteint à
travers la peau et bénéficie d'une bonne
irrigation sanguine. Après une injection
de gènes humains responsables de la
synthèse de l'insuline, préalablement
modifiés afin de pouvoir être incorporés
normalement dans des cellules
musculaires qui ne développent pas de
glandes à l'état naturel, on observe chez
les rats des taux quasi normaux d'insuline
humaine circulant dans le sang durant
près de cinq semaines. Les taux de
glycémie ont diminué de manière
significative sans pour autant être
dangereusement bas.
En utilisant des séquences d'ADN
développées dans des bactéries pour les
rendre résistant à l'antibiotique
tétracycline, la quantité d'insuline
produite et sécrétée par le muscle peut
être contrôlée et arrêtée au moyen de
cette substance non nocive. De même, en
utilisant des séquences d'ADN qui
régulent la production des gènes
responsables de la synthèse de l'insuline
en fonction des fluctuations de la
glycémie, nous espérons arriver par le
biais du génie génétique à une sécrétion
d'insuline effectivement adaptée aux
variations glycémiques à partir des
cellules musculaires propres du sujet
atteint de diabète. Cette technique offre
Lorsque des gènes sont injectés dans
un muscle, ce dernier les absorbe et
les active. Cette figure montre une
coupe transversale d'un muscle chez
un rat qui a reçu au moyen d'une
injection pratiquée sept jours
auparavant un gène synthétisant une
protéine fluorescente. Le gène a été
absorbé et activé pour produire la
protéine détectable par sa
fluorescence.
Avril 2002 Volume 47 Numéro 1
Orientations futures

34
la possibilité de restaurer des taux
d'insuline de base constants pendant des
périodes prolongées après une seule
injection et évite donc la transplantation
et l'immunosuppression.
L'option de la
transplantation
ne sera
vraisemblablement
pas viable pour la
majorité des
personnes atteintes
de diabète de type 1
partout dans le
monde.
Si toutefois nous devons reproduire le
pic de sécrétion d'insuline observé au
moment des repas, il faudra trouver un
système de libération rapide de l'insuline
stockée dans les cellules musculaires.
Dans cette optique, nous développons
actuellement un système devant
contribuer à cette fin en rendant les
cellules réceptives au médicament
administré par voie orale au moment des
repas. De cette manière,
l'approvisionnement de l'organisme en
insuline tant à l'état basal qu'au moment
des repas pourrait être restauré.
Les cellules hépatiques
Chez des rongeurs atteints de diabète,
un contrôle glycémique optimal a pu
être obtenu par le transfert dans le foie
d'un gène responsable de la synthèse
d'insuline, génétiquement conçu pour
être activé lors des élévations de la
glycémie. Une étude passionnante
révèle qu'en modifiant génétiquement
des cellules hépatiques en vue de
l'expression du gène PDX-1, régulateur
de la production d'insuline, on a obtenu
des cellules se comportant comme des
cellules bêta, secrétant de l'insuline en
réponse aux fluctuations de la glycémie
d'une manière proche de la normale. Le
succès du transfert des gènes dans le foie
a toutefois nécessité l'injection
intraveineuse de virus potentiellement
toxiques, bien que ces derniers aient été
modifiés afin de minimiser tout risque
d'infection virale généralisée.
Cellules intestinales
En dehors des cellules bêta du pancréas,
il existe peu de cellules ayant une
sécrétion hormonale modulée par le
glucose. Les 'cellules K' sont présentes
dans l'épithélium de l'intestin et
produisent une autre hormone, la 'GIP',
en réponse à une augmentation de la
glycémie après un repas. Chez des souris
génétiquement modifiées par un gène
combinant l'ADN responsable du
contrôle des taux de GIP avec l'ADN
provenant d'un gène de l'insuline humain
modifié, les cellules K produisirent
suffisamment d'insuline pour permettre
un contrôle optimal de la glycémie,
même après inactivation des cellules bêta
de l'animal. Il faudra développer une
méthode appropriée pour réussir le
transfert de ces gènes vers les cellules K
de personnes atteintes de diabète avant
de pouvoir envisager ces approches dans
des études cliniques.
Un enthousiasme prudent
Les approches de la thérapie génique
résumées dans cet article dans le cadre
du traitement du diabète semblent très
prometteuses.Toutes ces approches
devront néanmoins être peaufinées et
examinées avant d'envisager des essais
sur des êtres humains atteints de diabète.
Cependant, si nous parvenons à traduire
les résultats prometteurs des tests
réalisés sur des animaux en résultats
cliniques efficients, le génie génétique
jouera certainement un rôle
passionnant dans le traitement des
personnes atteintes de diabète dans
l'avenir.
Le Dr James Shaw est Professeur de
médecine et collaborateur principal de
Glaxo-Wellcome dans le domaine du
diabète à l'Université de Newcastle au
Royaume-Uni. Ses travaux portent
principalement sur la greffe de
pancréas entiers et d'îlots isolés. De
plus, son groupe de recherche en
sciences fondamentales explore la
possibilité d'une thérapie génique
pour le diabète utilisant les cellules
propres du receveur pour restaurer la
sécrétion de l'insuline.
Pour en savoir plus
BONNER-WEIR S., TANEJA M., WEIR G.C., et
al. In vitro cultivation of human islets from
expanded ductal tissue. Proc. Natl. Acad. Sci.
U.S.A., 97(14), 2000, pp. 7999-8004.
FERBER S., HALKIN A., COHEN H., et al.
Pancreatic and duodenal homeobox gene 1
induces expression of insulin genes in liver
and ameliorates streptozotocin-induced
hyperglycemia. Nature Med., 6, 2000,
pp. 568-572.
MACFARLANE W.M., CHAPMAN J.C.,
SHEPHERD R.M., et al. Engineering a
glucose-responsive human insulin-secreting
cell line from islets of Langerhans isolated
from a patient with persistent
hyperinsulinemic hypoglycemia of infancy.
J. Biol. Chem., 274, 1999, pp. 34059-34066.
SHAW J.A.M., DELDAY M.I., HART A.W.,
DOCHERTY K. Secretion of bioactive human
insulin following plasmid-mediated gene
transfer to non-neuroendocrine cell lines,
primarycultures and rat skeletal muscle in
vivo. J. Endocrinol., 172, 2002, pp. 653-672.
SORIA B., SKOUDY A., MARTIN F. From stem
cells to ß cells: new strategies in cell
therapy of diabetes mellitus. Diabetologia,
44(4), 2001, pp. 407-415.
James Shaw
Avril 2002 Volume 47 Numéro 1
Orientations futures
1
/
5
100%