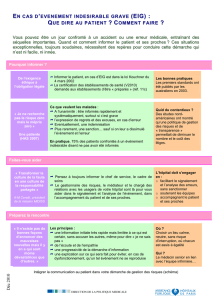
vigilance des essais cliniques - Recherche Clinique Paris Centre

1
Délégation Interrégionale à la Recherche Clinique
d’Ile-de-France
(Département de la Recherche Clinique et du Développement de
l’AP-HP)
www.dirc.aphp.fr
VIGILANCE DES ESSAIS CLINIQUES
Hélène Brocvielle

2
Délégation Interrégionale à la Recherche Clinique
d’Ile-de-France
(Département de la Recherche Clinique et du Développement de
l’AP-HP)
www.dirc.aphp.fr
PLAN
La réglementation en Europe et en France
Définitions et nouveaux acronymes
Obligations de l’investigateur
Obligations du promoteur
Vigilance des essais cliniques dont l’AP-HP est
promoteur
Comment améliorer la qualité des données

3
Délégation Interrégionale à la Recherche Clinique
d’Ile-de-France
(Département de la Recherche Clinique et du Développement de
l’AP-HP)
www.dirc.aphp.fr
VIGILANCE DES ESSAIS CLINIQUES :
LA RÉGLEMENTATION

4
Délégation Interrégionale à la Recherche Clinique
d’Ile-de-France
(Département de la Recherche Clinique et du Développement de
l’AP-HP)
www.dirc.aphp.fr
LA REGLEMENTATION EN EUROPE
Directive 2001/20/CE relative à l’application des bonnes pratiques
cliniques dans la conduite d’essais cliniques des médicaments à
usage humain :
Article 16 : Notification des événements indésirables
Article 17 : Notification des effets indésirables graves
Article 18 : Indications concernant les rapports
Detailed guidance :
Collection, verification and presentation of adverse event/reaction reports
arising from clinical trials on medicinal products for human use (« CT-3 »)
(juin 2011)
ICH guideline E2F
Note for guidance on development safety update reports (sept 2010)

5
Délégation Interrégionale à la Recherche Clinique
d’Ile-de-France
(Département de la Recherche Clinique et du Développement de
l’AP-HP)
www.dirc.aphp.fr
LA REGLEMENTATION EN FRANCE (1)
Loi de santé publique n°2004-806 du 9 août 2004
Décret n° 2006-477 du 26 avril 2006 relatif aux recherches
biomédicales
Dispositions spécifiques concernant les recherches biomédicales portant sur un
médicament à usage humain :
Arrêté du 19 mai 2006 fixant les modalités de déclaration, la forme et le contenu du
rapport de sécurité d'une recherche biomédicale portant sur un médicament à usage
humain
Arrêté du 24 mai 2006 fixant la forme, le contenu et les modalités des déclarations
d’effets indésirables et des faits nouveaux dans le cadre de recherche biomédicale
portant sur un médicament à usage humain
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%