L`apport de la psychologie et des neurosciences cognitives

FORMATION CONTINUE
L’apport de la psychologie et des neurosciences
cognitives dans l’exploration des substrats anatomiques
et fonctionnels impliqués dans le syndrome de Gilles de
la Tourette
The contribution of psychology and cognitive
neuroscience to the exploration of anatomical and
functional substrata implicated in the Gilles de la
Tourette’s syndrome
M. Mermillod
a,
*, C. Auxiette
a
, P. Chambres
a
, M. Dubois
b
, P. Derost
c
,
F. Galland
d,e
, F. Durif
c,e
, I. Jalenques
d,e
a
LAPSCO (CNRS UMR 6024), université Blaise-Pascal, 34, avenue Carnot, 63037 Clermont-Ferrand cedex, France
b
Laboratoire cognition et développement, université catholique de Louvain, Louvain-la-Neuve, Belgique
c
Service de neurologie A, CHU de Clermont-Ferrand, B.P. 69, 63003 Clermont-Ferrand cedex 1, France
d
Pôle de psychiatrie, service de psychiatrie de l’adulte A et psychologie médicale, CHU de Clermont-Ferrand, B.P. 69,
63003 Clermont-Ferrand cedex 1, France
e
Équipe d’accueil EA 3845, faculté de médecine, université de Clermont-1, 28, place Henri-Dunant, B.P. 38,
63001 Clermont–Ferrand cedex 1, France
Disponible sur Internet le 3 juin 2008
Résumé
L’objectif de cet article est de proposer quelques pistes d’explorations des bases neurales impliquées dans le syndrome de
Gilles de la Tourette. Les progrès actuels dans le domaine de la psychologie cognitive et des neurosciences cognitives
permettent d’ouvrir de nouvelles perspectives de recherches fondamentales et appliquées. Sur le plan fondamental, le
syndrome de Gilles de la Tourette permet l’élaboration d’un modèle théorique unique d’exploration des processus
d’intégration des informations sensorimotrices, limbiques et associatives des ganglions de la base. Sur le plan clinique, la
compréhension de ce modèle devrait permettre en retour la mise en place de nouvelles techniques de remédiations
psychiatriques, neurochirurgicales et psychothérapeutiques.
ß2008 Elsevier Masson SAS. Tous droits réservés.
Abstract
Different lines of research are currently being explored in order to determine the neural basis involved in Gilles de la
Tourette’s syndrome. Current results in the field of cognitive psychology and cognitive neuroscience permit a better
understanding of the neurobiological and cognitive underpinnings of this pathology. At a fundamental level, Gilles de la
Tourette’s syndrome actually constitutes a unique theoretical model of sensory–motor, limbic and associative integration
Annales Médico-Psychologiques 166 (2008) 398–402
* Auteur correspondant.
Adresse e-mail : [email protected] (M. Mermillod).
0003-4487/$ see front matter ß2008 Elsevier Masson SAS. Tous droits re
´serve
´s.
doi:10.1016/j.amp.2008.04.003

in the basal ganglia. At a clinical level, a better understanding of the functional architecture of the basal ganglia should permit
better psychiatric, neurosurgery and psychotherapy healthcare.
ß2008 Elsevier Masson SAS. Tous droits réservés.
Mots clés : Ganglions de la base ; Neurosciences cognitives ; Psychologie cognitive ; Sciences cognitives ; Syndrome de Gilles de la
Tourette
Keywords: Basal ganglia; Cognitive neuroscience; Cognitive psychology; Cognitive science; Gilles de la Tourette’s syndrome
Le syndrome de Gilles de la Tourette (SGT) est une
pathologie neuropsychiatrique à la physiopathologie mal
connue, une origine multifactorielle génétique, environnemen-
tale et neurobiologique étant aujourd’hui admise [28].
L’expression clinique de la maladie est variable et hétérogène,
avec une association de troubles moteurs, psychiatriques et
comportementaux [24]. Les manifestations motrices consis-
tent en des tics, soit moteurs (mouvements anormaux
involontaires brefs et intermittents), soit vocaux (émissions
vocales incontrôlées). Elles peuvent être simples (mouvements
simples, blépharospasmes, cris, bruits de gorge) ou bien plus
complexes (copro- et échophénomènes moteurs et vocaux :
copropraxie, échopraxie, coprolalie, écholalie, palilalie).
Les données de neuro-imagerie obtenues chez l’homme par
imagerie par résonance magnétique fonctionnelle (IRMf)
indiquent que le cortex et le système des ganglions de la base
sont les deux principaux systèmes impliqués dans cette
pathologie [21]. Le système des ganglions de la base,
aujourd’hui connu pour traiter différents types d’informations
motrices, cognitives et émotionnelles [6], comprend une
boucle principale qui reçoit ses afférences de l’ensemble du
cortex cérébral et projette, par l’intermédiaire de deux
structures inhibitrices disposées en série – le striatum et le
globus pallidus – vers le thalamus moteur et le cortex frontal.
Selon l’origine topographique de l’entrée corticale, trois zones
fonctionnelles ont été individualisées : une zone sensorimotrice
provenant du cortex central, une zone associative provenant
du cortex préfrontal et une zone limbique provenant des
cortex orbitofrontal et cingulaire antérieur. Ces territoires
traitent des informations sensorimotrices, cognitives et
émotionnelles/motivationnelles respectivement.
1. BASES ANATOMOFONCTIONNELLES ET
PHYSIOPATHOLOGIQUES
Deux hypothèses physiopathologiques prédominent actuel-
lement. D’une part, l’hypothèse d’une hyperdopaminergie
sous-corticale trouve des arguments dans l’efficacité théra-
peutique (même relative) sur les tics, les substances adminis-
trées bloquant les récepteurs dopaminergiques [8,29]. D’autre
part, l’imagerie cérébrale a mis en évidence l’implication du
cortex et des ganglions de la base dans le SGT [21]. Les
ganglions de la base regroupent les noyaux gris centraux que
sont le striatum (noyau caudé et putamen), le pallidum (externe
et interne-GPi), la substance noire (reticulata compacta, SNr)
et le noyau sous-thalamique. Ils reçoivent à travers trois circuits
principaux des informations des territoires sensorimoteur,
limbique et associatif du cortex cérébral.
Un dysfonctionnement au niveau des ganglions de la base, en
interaction avec les structures corticales motrices et cognitives
associées, expliquerait la diversité des symptômes du SGT.
Albin et Mink [2] soutiennent l’hypothèse d’une défaillance des
mécanismes de sélection des programmes moteurs au niveau
des ganglions de la base. En conditions physiologiques, quand un
mouvement désiré a débuté, un mécanisme favoriserait ce
programme moteur en freinant au niveau du GPi et de la SNr
les programmes non désirés, concurrents potentiels. Dans le
SGT, certains programmes moteurs non désirés ne seraient
plus inhibés, d’où les tics et comportements répétitifs. En fait,
des neurones striataux seraient anormalement actifs, entraî-
nant une augmentation de l’inhibition GABAergique exercée
par le striatum sur les voies de sortie, les neurones du GPi et de
la SNr, dont l’influence inhibitrice sur le thalamus diminuerait,
permettant l’apparition des tics.
2. LE SYNDROME DE GILLES DE LA TOURETTE
ET LA RECONNAISSANCE D’EXPRESSIONS
FACIALES ÉMOTIONNELLES (EFE)
Le déséquilibre du système dopaminergique dans le SGT,
probablement lié à une hyperdopaminergie sous-corticale,
pourrait aussi avoir pour conséquence un déficit spécifique
dans la reconnaissance de certaines expressions émotionnelles
[10–12,14–17,20,23,25]. Ces conséquences fonctionnelles au
niveau du contrôle de l’humeur et dans le contrôle émotionnel
pourraient avoir pour base la partie ventrale des noyaux gris
centraux en relation avec le cortex frontal et l’amygdale [13].
Ces liens pourraient impliquer aussi le noyau accumbens qui
peut être considéré comme la partie ventrale du noyau caudé. Il
existe également des relations entre les autres parties ventrales
des noyaux gris centraux (putamen, pallidum, noyau sous-
thalamique) et l’amygdale [13].
Parallèlement à ces données neurophysiologiques, différents
travaux en psychologie montrent des déficits dans la
reconnaissance de certaines expressions faciales émotionnelles
[27] par des patients souffrant du SGT. Plus particulièrement,
Sprengelmeyer et al. [27] ont montré que le déficit de
reconnaissance faciale émotionnelle semblerait focalisé sur les
expressions de dégoût pour des patients souffrant du SGT avec
comorbidité psychiatrique (TOC). Ce déficit dans la reconnais-
sance de l’EFE de dégoût ne semble pas lié à un déficit de
reconnaissance sémantique du dégoût. Dès lors, ce déficit
pourrait concerner des circuits neuronaux impliqués dans le
traitement moteur et émotionnel. Ces travaux suggèrent que
les troubles moteurs et verbaux des patients atteints du SGT
avec TOC pourraient être liés à une altération d’une ou de
M. Mermillod et al. / Annales Médico-Psychologiques 166 (2008) 398–402 399

plusieurs composantes du système limbique. Ces auteurs n’ont
néanmoins pas pu mettre en évidence, chez les patients
souffrant du SGT sans TOC, de déficit de reconnaissance
d’expressions faciales émotionnelles. Des travaux complémen-
taires pourraient néanmoins permettre de mettre en évidence
une éventuelle altération spécifique dans la reconnaissance
de certaines fréquences spatiales constituant les EFE, au
regard de données récentes provenant des neurosciences
cognitives [30].
3. LES TRAVAUX ACTUELS EN
NEUROSCIENCES COGNITIVES ET EN
PSYCHOLOGIE
Les travaux actuels en neurosciences cognitives ont montré
la complexité des circuits neuronaux impliqués dans la
reconnaissance et la catégorisation de stimuli visuels comple-
xes, telles que les expressions faciales émotionnelles [5]. Les
structures impliquées concernent des zones de projection
corticales (cortex temporal antérieur, gyrus occipital inférieur,
gyrus fusiforme), mais aussi différentes structures sous-
corticales liées au système limbique, même si les travaux de
neuroanatomie fonctionnelle actuels ne permettent pas encore
de déterminer leurs rôles exacts dans l’ensemble des réseaux
neuronaux impliqués.
Parallèlement, des travaux de neuropsychologie montrent
que des lésions de l’amygdale, du cortex pariétal et du cortex
ventral entraînent un déficit de reconnaissance des EFE [1].
Les ganglions de la base et l’insula seraient impliqués dans la
reconnaissance du dégoût [26] et le putamen dans la
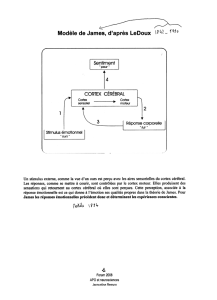
reconnaissance de la joie [22]. Enfin, les travaux de Ledoux
[13], de Breiter et al. [3] et de Morris et al. [19] montrent une
implication prépondérante de l’amygdale dans le traitement
sensoriel et cognitif de l’information de peur. L’amygdale
serait ainsi une composante importante du système impli-
quant l’acquisition, le stockage et l’expression de la peur.
Néanmoins, Yang et al. [31] ont montré une activation
bilatérale de l’amygdale aux expressions faciales de joie,
tristesse, colère et peur par rapport à l’expression neutre,
dépassant ainsi la simple réponse de l’amygdale aux stimuli de
peur. La réponse de l’amygdale semblerait ainsi impliquée dans
la modulation du niveau de vigilance de l’organisme en
réaction à un stimulus émotionnel. Le modèle de Ledoux [13]
montre chez le rat l’existence d’une voie sous-corticale basse
fréquence vers le système limbique dans le traitement
d’informations émotionnelles.Cettevoiebassefréquence
serait rapide et grossière, à la différencedevoiescorticales
hautes fréquences, qui contiennent tous les détails du signal
auditif ou visuel, mais qui véhiculeraient cette information de
façon beaucoup plus lente vers les zones de projections
corticales.
Notons enfin que les travaux sur le blindsight, c’est-à-dire la
perception non consciente par des patients hémianopsiques
(patients ayant une lésion unilatérale du cortex visuel primaire)
du contenu émotionnel de visages présentés dans leur
hémichamp aveugle [5], ont tenté de déterminer les bases
neuroanatomiques à l’origine de cette perception. Ces travaux
corroborent de façon indirecte l’hypothèse avancée par Ledoux
[13] de l’existence d’une voie sous-corticale directe entre le
système visuel primaire (plus précisément, les corps genouillés
latéraux au niveau du thalamus) et le système limbique
(l’amygdale et les structures limbiques associées). Cette voie
sous-corticale directecourt-circuiterait le cortex visuel primaire
(V1), mais aussi les voies corticales dorsales et ventrales (plus
particulièrement, le gyrus occipital inférieur et le gyrus
fusiforme). L’objectif de ces projections directes du système
perceptif vers l’amygdale serait une mise en éveil rapide du
système cognitif, par les différentes structures émotionnelles
sous-corticales composant le système limbique, en présence
d’un stimulus dangereux dans l’environnement. Cette inter-
prétation est corroborée par des données en potentiels évoqués
montrant qu’une activation semblant provenir de l’amygdale se
produit 120 ms après la présentation d’un stimulus de peur, alors
que la réponse au niveau du cortex ventral n’apparaît que 170 ms
après la présentation du stimulus [7].
Corroborant ces travaux, une étude de neuro-imagerie
(IRMf, [30]) suggère une fois de plus la possibilité chez l’homme
d’une voie sous-corticale directe entre le système visuel primaire
et l’amygdale, comme proposé dans le modèle de Ledoux [13].
Ces travaux ont montré l’existence d’une réponse hémodyna-
mique au niveau du colliculus supérieur et de l’amygdale via le
pulvinar, lors de la présentation d’images de visages filtrées en
basses fréquences spatiales et présentant une expression de peur
par rapport à une expression neutre. Ces résultats suggèrent
donc que la transmission du signal lié aux expressions faciales de
peur pourrait court-circuiter le cortex visuel primaire en
empruntant une voie sous-corticale véhiculant très rapidement
l’information de basses fréquences spatiales (Fig. 1). Ces travaux
montrent également qu’à l’inverse, les images de visages filtrées
en hautes fréquences spatiales activent peu ou pas l’amygdale, et
le signal issu de ces visages semble emprunter la voie ventrale
(V1, puis occipitotemporal).
Le système visuel primaire humain réalise, en effet, une
décomposition de l’information en termes de fréquences
spatiales de la rétine au cortex strié (ou V1) via les corps
genouillés latéraux où se démarquent notamment les voies
magnocellulaires et les voies parvocellulaires [9]. Les pro-
priétés de ces deux voies montrent des caractéristiques
spatiotemporelles asymétriques du traitement visuel. Les voies
magnocellulaires sont achromatiques, passe-bas au niveau des
fréquences spatiales, mais passe-haut au niveau des fréquences
Fig. 1. Exemple de visage non filtré (image de gauche), filtré en basses
fréquences spatiales (image du centre) et filtré en hautes fréquences spatiales
(image de droite).
M. Mermillod et al. / Annales Médico-Psychologiques 166 (2008) 398–402400

temporelles (voies myélinisées). À l’inverse, les voies parvo-
cellulaires, non myélinisées, véhiculent plus lentement l’inté-
gralité du spectre fréquentiel. Par ailleurs, l’intégration de
l’information visuelle serait dirigée par un biais coarse-to-fine
lors de la reconnaissance de scènes naturelles [4], mais aussi
d’EFE [18]. Autrement dit, l’information plus rapide issue des
basses fréquences spatiales (voie magnocellulaire) fournirait un
aperçu global de la structure de l’image et permettrait une
première catégorisation perceptive qu’affineraient les informa-
tions locales issues des hautes fréquences spatiales dont
l’extraction est plus tardive (voies parvocellulaires). Dans cette
perspective, les travaux de Vuilleumier et al. [30] permettent de
supposer un couplage « propriétés du signal/circuiterie » aux
fonctionnalités cognitives différentes : un couplage « BF – voie
magnocellulaire » ayant pour objet la catégorisation émotion-
nelle des visages, versus un couplage « HF – voie
parvocellulaire » ayant pour objet l’identification des visages.
4. CONCLUSION
Les recherches menées actuellement ont pour objectif la
différenciation des structures limbiques, associatives et sensori-
motrices composant les ganglions de la base. Dans cette
perspective, le SGT offre un modèle théorique unique dans la
mesure où il s’agit d’une pathologie impliquant ces trois
composantes fonctionnelles constituant les ganglions de la base.
L’étude de la reconnaissance d’EFE dans ce domaine est un outil
particulièrement efficace pour ce type de recherches, car il
permet l’exploration de déficits perceptifs, émotionnels ou
cognitifs chez les patients victimes du SGT. Ainsi, nous testons
actuellement plusieurs hypothèses concernant un déficit
spécifique du canal HF (impliquant principalement des zones
corticales) en comparaison avec le canal BF (qui pourrait avoir
des relations privilégiées avec les structures sous-corticales)
dans le SGT. Néanmoins, l’objectif de cet article est de montrer
que les véritables progrès seront réalisés par l’intégration de
données issues de la psychiatrie, de la psychologie cognitive et
des neurosciences cognitives dans une réelle dimension
pluridisciplinaire. Par ailleurs, l’utilisation récente de la stimula-
tion cérébrale profonde ouvre de nouvelles perspectives de
recherches innovantes dans ce cadre. L’activation ou l’inhibition
de différents substrats neuroanatomiques liés aux ganglions de la
base devrait, en effet, permettre d’observer, dans un cadre
expérimental, les conséquences de ces interventions au niveau
comportemental et physiopathologique. Dans le cadre de la
psychologie cognitive, la reconnaissance d’EFE devrait permettre
de déterminer avec précision, en fonction de la zone stimulée ou
inhibée, la fonction cognitive, émotionnelle ou sensorimotrice
modifiée par l’électrostimulation.
Quel en sera le bénéfice pour les patients ? L’objectif
prioritaire actuel est de comprendre comment et pourquoi les
composantes limbiques, associatives et sensorimotrices sont
ainsi intriquées au sein des ganglions de la base, en interaction
avec des zones d’afférences et d’efférences corticales spécifi-
ques. La compréhension de la circuiterie neurofonctionnelle
impliquée dans le SGT, ainsi que des altérations à l’origine du
syndrome permettront tout d’abord un meilleur ciblage
médicamenteux. La compréhension du modèle permettra, en
effet, de déterminer quel médicament sera le plus efficace en
fonction de chaque altération spécifique. Les applications sont
encore plus évidentes sur le plan neurochirurgical, puisqu’il sera
possible d’utiliser la stimulation cérébrale profonde sur des
zones de ciblage qui seront de plus en plus précises et qui
permettront surtout de différencier les composantes cognitives,
sensorimotrices et émotionnelles, ainsi que les conséquences
comportementales de l’électrostimulation pour les patients sur
ces trois dimensions fonctionnelles. Enfin, la prise en charge et
l’accompagnement psychothérapeutique seront aussi améliorés
par la meilleure connaissance de l’origine du SGT.
Remerciements
Ce travail a été réalisé grâce à un financement de l’Agence
nationale pour la recherche (Projet ANR n
o
BLAN06-
2_145908, Projet ANR-06-CORP-019) et un programme
hospitalier de recherche clinique (PHRC) financé par le
CHU de Clermont-Ferrand ainsi qu’aux moyens mis en œuvre
par le CNRS (UMR 6024).
RÉFÉRENCES
[1] Adolphs R, Tranel D, Damasio H, Damasio A. Impaired recognition of
emotion in facial expressions following bilateral damage to the human
amygdala. Nature 1994;372:669–72.
[2] Albin RL, Mink JW. Recent advances in Tourette syndrome research.
Trends Neurosci 2006;29:175–82.
[3] Breiter HC, Etcoff NL, Whalen PJ, Kennedy WA, Rauch SL, Buckner RL,
et al. Response and habituation of the human amygdala during visual
processing of facial expression. Neuron 1996;17:875–87.
[4] Bullier J. Integrated model of visual processing. Brain Res Rev
2001;36:96–107.
[5] de Gelder B, Vroomen J, Pourtois G, Weiskrantz L. Non-conscious
recognition of affect in the absence of striate cortex. NeuroReport
1999;10:3759–63.
[6] DeLong M. Primate models of movement disorders of basal ganglia origin.
Trends Neurosci 1990;13:281–5.
[7] Eimer M, Holmes A. An ERP study on the time course of emotional face
processing. NeuroReport 2002;13:427–31.
[8] Graybiel AM, Canales JJ. The neurobiology of repetitive behaviors: Clues
to the neurobiology of Tourette syndrome. Adv Neurol 2001;85:123–31.
[9] Hubel HD, Wiesel TN. Ferrier lecture: Functional architecture
of macaque monkey visual cortex. Proc R Soc Lond B Biol Sci
1977;98:1–59.
[10] Hughes HC, Nozawa G, Kitterle FL. Global precedence, spatial frequency
channels, and the statistic of the natural image. J Cogn Neurosci
1996;8:197–230.
[11] Ivry RB, Robertson LC. The two sides of perception. Cambridge MA: MIT
Press; 1998.
[12] Kawasaki H, Kaufman O, Damasio H, Damasio AR, Granner M, Bakken H,
et al. Single-neuron responses to emotional visual stimuli recorded in
human ventral prefrontal cortex. Nat Neurosci 2001;4:15–6.
[13] Ledoux J. The emotional brain: The mysterious underpinnings of
emotional life. New York: Simon, Shuster; 1996.
[14] Marendaz C, Rousset S, Charnallet A. Reconnaissance des scènes, des
objets et des visages : modèles théoriques et neuropsychologiques. In:
Delorme A, Fluckiger M, editors. Perception et réalité. Montréal: Gaëtan
Morin Éditeur; 2003.
[15] Mermillod M, Guyader N, Chauvin A. The coarse-to-fine hypothesis
revisited: Evidence from neuro-computational modelling. Brain Cogn
2005;57:151–7.
M. Mermillod et al. / Annales Médico-Psychologiques 166 (2008) 398–402 401

[16] Mermillod M, Guyader N, Chauvin A. Improving generalisation skills in a
neural network on the basis of neurophysiological data. Brain Cogn
2005;58:246–8.
[17] Mermillod M, Guyader N, Vuilleumier P, Alleysson D, Marendaz C. How
diagnostic are spatial frequencies for fear recognition? In: Bara BG,
Barsalou L, Bucciarelli M, editors. Proceedings of the 27th Annual
Conference of the Cognitive Science Society. Mahwah, New Jersey:
Lawrence Erlbaum Associates; 2005. p. 1501–6.
[18] Mermillod M, Guyader N, Peyrin C, Alleysson D, Marendaz C.
Avantage computationnel de l’information de basse fréquence spatiale
dans la reconnaissance d’expressions faciales de peur par un réseau de
neurones artificiels. Cahier Romans Sci Cogn (InCognito)
2006;3:23–36.
[19] Morris JS, Frith CD, Perrett DI, Rowland D, Young AW, Calder AJ, et al. A
differential neural response in the human amygdala to fearful and happy
facial expressions. Nature 1996;383:812–5.
[20] Pegna AJ, Khateb A, Lazeyras F, Seghier ML. Discriminating emotional
faces without primary visual cortices involves the right amygdala. Nat
Neurosci 2004;8:24–5.
[21] Peterson BS, Skudlarski P, Anderson AW, Zhang H, Gatenby JC,
Lacadie CM, et al. A functional magnetic resonance imaging study
of tic suppression in Tourette syndrome. Arch Gen Psychiatry
1998;55:326–33.
[22] Phillips ML, Bullmore ET, Howard R, Woodruff PW, Wright IC, Williams
SC, et al. Investigation of facial receognition memory and happy and sad
facial expression perception: An fMRI study. Psychiatry Res
1998;83:127–38.
[23] Pourtois G, Thut G, Grave de Peralta R, Michel C, Vuilleumier P. Two
electrophysiological stages of spatial orienting towards fearful faces: early
temporo-parietal activation preceding gain control in extrastriate visual
cortex. Neuroimage 2005;26:149–63.
[24] Robertson MM. Mood disorders and Gilles de la Tourette’s syndrome: An
update on prevalence, etiology, comorbidity, clinical associations, and
implications. J Psychosom Res 2006;61:349–58.
[25] Rossion B, de Gelder B, Pourtois G, Guérit JM, Weiskrantz L. Early
extrastriate activity without primary visual cortex in humans. Neurosci
Lett 2000;279:25–8.
[26] Sprengelmeyer R, Young AW, Calder AJ, Karnat A, Lange H, Hömberg V,
et al. Loss of disgust. Perception of faces and emotions in Huntington’s
disease. Brain 1996;119:1647–65.
[27] Sprengelmeyer R, Young AW, Pundt I, Sprengelmeyer A, Calder AJ,
Berrios G, et al. Disgust implicated in obsessive-compulsive disorder. Proc
Biol Sci 1997;264:1767–73.
[28] Stern JS, Burza S, Robertson MM. Gilles de la Tourette’s syndrome and its
impact in the UK. Postgrad Med J 2005;81:12–9.
[29] Stern E, Silbersweig DA, Chee KY, Holmes A, Robertson MM, Trimble M,
et al. A functional neuroanatomy of tics in Tourette syndrome. Arch Gen
Psychiatry 2000;57:741–8.
[30] Vuilleumier P, Armony JL, Driver J, Dolan RJ. Distinct spatial frequency
sensitivities for processing faces and emotional expressions. Nat Neurosci
2003;6:624–31.
[31] Yang TT, Menon V, Eliez S, Blasey C, White CD, Reid AJ, et al. Amygdalar
activation associated with positive and negative facial expression.
NeuroReport 2002;13:1737–41.
M. Mermillod et al. / Annales Médico-Psychologiques 166 (2008) 398–402402
1
/
5
100%


![[Le date mois 2017] [M. Jones 123, boul. Magnolia VotreVille, BC](http://s1.studylibfr.com/store/data/000208200_1-2bea22d51e4dc0b373289ccce2e12b96-300x300.png)




