Spectroscopie 1. Objet et principe de la spectroscopie La

Fiche cours.
STL BGB
Spectroscopie
20/09/2007
Cours_spectroscopie.doc
1/7
1. Objet et principe de la spectroscopie
La spectroscopie est l'ensemble des techniques qui permettent
d'analyser la lumière émise par une source lumineuse, ou la lumière
transmise ou réfléchie par un corps absorbant.
Pour cela, on utilise un spectroscope (doc 1) qui permet d'observer et
d'étudier le spectre obtenu, c'est-à-dire l'ensemble des radiations
constituant cette lumière.
Le spectroscope comporte donc un système dispersif, prisme ou
réseau, qui sépare les différentes radiations composant le
rayonnement analysé.
Il existe différents types de spectres : spectres d'émission et spectres
d'absorption ; spectres continus et spectres de raies.
Doc 1 : Spectroscope à prisme.
a. Principe des spectroscopes à prisme
Expérience.
Une source de lumière blanche éclaire une fente F. Avec une lentille convergente L, on forme l’image de cette
fente (F) sur un écran (F’) (doc 2a). On interpose le prisme de verre d’indicez n sur le trajet de la lumière.
Le faisceau lumineux est alors dévié vers la base du prisme, et nous voyons apparaître une plage continue aux
couleurs de l'arc en ciel (doc 2b), dans laquelle on distingue successivement : le rouge, l'orangé, le jaune, le
vert, le bleu, l'indigo et le violet. L'ensemble de ces couleurs constitue le spectre de la lumière blanche.
La lumière blanche est donc une lumière complexe, résultant de la superposition d'une infinité de radiations
colorées.
lampe
fente F écran
F’
lentille
prisme
doc 2b
Doc 2a : Dispersion de la lumière blanche par un prisme : Le violet est plus dévié que le rouge car l’indice de réfraction du verre est plus grand
pour le violet que pour le rouge :
2
b
n a
λ
= +
ou a et b sont des constantes.
Interprétation : Le phénomène de dispersion.
Chaque lumière monochromatique est une onde électromagnétique caractérisée par sa fréquence ν, ou sa
longueur d'onde dans le vide λ
0
. L'indice de réfraction du prisme a une valeur plus grande pour les radiations
violettes, de plus courtes longueurs d'onde (λ
0
= 400 nm), que pour les radiations rouges de plus grandes
longueurs d'onde (λ
0
= 800 nm). La déviation résultant de la double réfraction est donc plus grande pour les
radiations de courtes longueurs d'onde ; les différentes radiations composant une lumière polychromatique sont
alors séparées après traversée du prisme : on dit qu’il y a dispersion.
Dans la pratique, le spectroscope comporte un cercle gradué (ou goniomètre) pour la mesure précise des
angles, et une graduation micrométrique qui permet de repérer avec précision les différentes radiations
monochromatiques (voir TP).
b. Principe des spectroscopes à réseau
Expérience

Fiche cours.
STL BGB
Spectroscopie
20/09/2007
Cours_spectroscopie.doc
2/7
Une source de lumière blanche éclaire une fente F. Avec une lentille convergente L, on forme l’image de cette
fente (F) sur un écran (F’) (doc 3a). On interpose alors devant la fente source un réseau dont les traits sont
parallèles à la direction de la fente.
Nous observons sur l'écran, de part et d'autres de l'image F', plusieurs spectres de la lumière banche, disposés
symétriquement deux à deux par rapport à F’ (doc 3b). Contrairement à l’expérience réalisée avec un prisme, la
lumière rouge est ici plus éloignée de l'axe que la lumière violette.
Doc 3a : Dispersion de la lumière par un réseau :
Onobtient au centre une image blanche de la fente, puis les spectres d’ordre 1 (S1 et S’1),
d’ordre 2 …
Doc 3b
Interprétation
La lumière incidente est diffractée par le réseau; puis, les faisceaux diffractés interfèrent entre eux. On observe
alors un maximum de lumière dans les direction θ caractérisées par la relation
sin k n
θ λ
= ⋅ ⋅
avec
k
∈
, n
étant le nombre de traits par mètre du réseau., et λ la longueur d'onde. (cf cours Diffraction/interférence)
Si k=1 (spectre d'ordre 1) la relation devient
sin n
θ λ
= ⋅
. Cela montre que les radiations de courtes longueurs
d’onde sont moins déviées que les radiations de plus grandes longueurs d’onde. (le rouge est donc la radiation
la plus déviée.
Le réseau de diffraction permet donc de séparer les différentes radiations composant une lumière
polychromatique.
c. Conclusion
L'analyse spectrale d'une lumière consiste à séparer les différentes radiations qui la composent, en
obtenant un spectre.
Dans un spectroscope à prisme, la séparation des différentes radiations est due au phénomène de
réfraction.
Dans un spectroscope à réseau, la séparation des différentes radiations est due au phénomène de
diffraction et d’interférence.
2 Les spectres d’émission
Ce sont des spectres qui apparaissent brillants sur fond sombre; on distinguera les spectres continus et les spectres de
raies.
2.1 Les spectres continus
a) Obtention.
Les expériences précédemment réalisées pour illustrer le principe des spectroscopes nous ont montré des
spectres de lampes à incandescence constitués par une large plage colorée et continue, formée par la
juxtaposition d'une infinité d'images colorées de la fente source. Dans ces spectres, aussi fine que soit la fente-
source, il n'est pas possible de distinguer des images colorées : ce sont des spectres continus.
L'expérience montre que les solides, les liquides, ou les gaz très comprimés, fortement chauffés, émettent une
lumière dont le spectre est continu. C'est le cas des métaux incandescents.
b) Influence de la température sur la lumière émise

Fiche cours.
STL BGB
Spectroscopie
20/09/2007
Cours_spectroscopie.doc
3/7
On peut faire varier, grâce à un montage
potentiométrique, l'intensité du courant circulant dans
la lampe. On agit donc sur la température du filament
de la lampe à incandescence (doc.4).
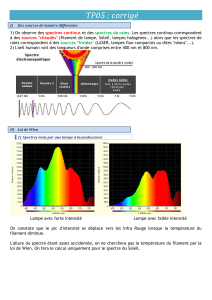
Quand la température augmente, le spectre s’étale du
rouge au violet et devient plus lumineux.
doc 4
Pour des températures relativement faibles (600°C), le filament, peu lumineux, émet une lumière rouge-orangé.
Le spectre observé est très peu lumineux, et il ne comporte que des radiations rouges, orangées et jaunes.
En augmentant la température du filament, celui-ci devient plus brillant, et la lumière émise est jaune vif. Le
spectre est dans l'ensemble plus lumineux, mais surtout, on voit apparaître successivement d'autres couleurs,
vers les plus courtes longueurs d'ondes : le vert (800°C), puis le bleu (1000°C).
Pour une température encore plus élevée (1300°C), la lumière émise est blanche. Dans le spectre, apparaît le
violet, tandis que le jaune et le vert sont beaucoup plus lumineux.
Ainsi, quand la température varie, nous observons des modifications quantitatives et qualitatives dans le
rayonnement émis.
La puissance lumineuse émise augmente avec la température, mais sa composition change : les radiations
de plus courtes longueurs d'onde (bleu, violet) ne sont pratiquement émises qu'à partir de températures
élevées.
Le document 5 montre que le maximum de puissance émise par un solide incandescent se déplace vers le violet
quand la température augmente.
L'analyse du rayonnement continu renseigne donc sur la température de la surface émettrice. Ce phénomène est
particulièrement utilisé dans les méthodes de l'astrophysique, et par les techniques de mesure des températures
élevées (pyrométrie optique).
doc 5
c) Conclusion.
Les solides ou les liquides portés à haute température émettent un rayonnement continu dont la composition
varie en fonction de la température.
2.2 Les spectres de raies
a) Obtention.
Température
croissante

Fiche cours.
STL BGB
Spectroscopie
20/09/2007
Cours_spectroscopie.doc
4/7
On remplace la lampe à incandescence par une lampe à vapeur
de mercure (doc 6a). L'ampoule d'une telle lampe, dite
spectrale, contient des traces de mercure; elle est alimentée par
un dispositif assurant des décharges électriques entre deux
électrodes. Après quelques minutes de fonctionnement, une
vapeur de mercure sous faible pression remplit l'ampoule, et
émet une lumière bleutée sous l'action des décharges
électriques.
L'observation du spectre de cette lumière révèle l'existence de
quelques raies brillantes, apparaissant sur un fond sombre: c'est
un spectre de raies d'émission. (doc 6b)
Le spectre de raies est un spectre discontinu; il ne comporte
que certaines raies.
Doc 6a : Ampoule contenant un gaz rare et une
petite quantité de mercure.
On chauffe les filaments puis on applique une
tension qui provoque des décharges électriques.
Le mercure se vaporise au bout de quelques
minutes et on observe alors une lumière jaune
bleutée caractéristique du mercure.
b) Spectre de raies et élément chimique
Le spectre d'une lampe à vapeur de sodium
comporte essentiellement deux raies brillantes
jaunes très rapprochées appelées doublet jaune,
respectivement à 589,0 et 589,6 nm (doc.7a).
Le doublet est caractéristique de l'élément sodium.
L'observation de ce doublet. permet de révéler la
présence de sodium (sous forme atomique Na ou
ionique Na
+
) dans la source lumineuse émettrice.
Un fil de platine trempé dans une solution de
chlorure de sodium et porté dans une flamme
colore celle-ci en jaune (caractéristique de
l’élément sodium)
c) Conclusion.
Les gaz portés à température élevée, ou dans lesquels on provoque des décharges électriques, émettent des
spectres de raies d'émission caractéristiques des éléments chimiques présents dans la vapeur émettrice.
Cette propriété est particulièrement utile pour l'étude des sources lointaines que sont les astres : étoiles,
nébuleuses et galaxies.

Fiche cours.
STL BGB
Spectroscopie
20/09/2007
Cours_spectroscopie.doc
5/7
La spectroscopie de flamme permet de confirmer
la présence de certains ions en solution Na
+
(jaune); K
+
(rouge carmin); Li
+
(rouge pâle) ; Ca
2+
(rouge-orangé) ; Ba
2+
(jaune-vert); Cu2+ (vert) ;
Sr
2+
(rouge vif). (Doc8 a et b)
(a) (b)
Doc 8 : Test
de flamme
a :ion baryum
b :ion strontium
2.3 Les spectres de bandes
Si la vapeur chauffée ou excitée par décharges électriques est constituée de molécules, les spectres observés
sont constitués de plusieurs séries de raies infiniment rapprochées qui donnent dans le spectre des bandes
colorées : il s'agit de spectres de bandes.
Les spectres de bandes renseignent sur les éléments chimiques présents dans la vapeur, mais aussi sur la nature
des liaisons entre les atomes, donc sur la structure des molécules.
L'étude des spectres de bandes, dans l'infrarouge notamment, est très utilisée en chimie organique.
3 Les spectres d’absorption
Contrairement aux spectres de raies, les spectres d'absorption apparaissent en sombre sur fond lumineux.
3.1 Spectre d'absorption atomique
a) Obtention et observation de raies d'absorption.
Dans le montage du document 8, on brule un coton imbibé d’une solution saturée de chlorure de sodium et
d’alcool, on obtient ainsi des vapeurs de sodium atomique. Une source de lumière blanche éclaire une fente et
la lumière traverse les vapeurs de sodium.
Si on analyse la lumière blanche après la traversée des vapeurs de sodium, le spectre observé est celui de la
lumière blanche, mais il présente une raie sombre (en fait, il s’agit de deux raies sombres très rapprochées)
située dans le jaune-orangé. Des mesures précises donneraient les positions de ces raies sombres dans le spectre
: elles correspondent aux longueurs d'onde du doublet d'émission du sodium, soit 589,0 nm et 589,6 nm.
Doc 8 : Spectre d’absorption du sodium.
b) Interprétation.
L'existence des raies sombres dans le spectre montre que les longueurs d'onde correspondantes sont absentes de
la lumière : elles ont été absorbées par les atomes de la vapeur traversée; ce sont des raies d'absorption. Nous
constatons de plus que les longueurs d'onde absorbées dans ces conditions par la vapeur de sodium sont
identiques à celles émises par la même vapeur.
Loi de Kirchhoff :
Tout élément chimique à l'état gazeux (atomique ou ionique) peut absorber dans la lumière blanche
qui l'éclaire les mêmes radiations monochromatiques qu'il est susceptible d'émettre.
c) Conclusion.
 6
6
 7
7
1
/
7
100%