Le 5-FU oral

113
••••••••
lementdisponiblesetutilisésen
cancérologie digestive:le Xeloda®
(capécitabine) etl’UFT®(association
tégafur-uracile). La placedecesmédi-
caments en cancérologie est actuelle-
mentcroissanteetd’autresdérivéssont
en cours de développement,telsque
le composéS1associantle tégafur,le
5-chloro-2,4dihydropyridine (uninhi-
biteur de laDPD)etl’oxanatedepotas-
sium(inhibiteur de laphosphorylation
du5-FU en 5-FUMP).
Pharmacologie de
lacapécitabine et
de l’association
tégafur-uracile
L’activitépharmacologiquedu5-FU
nécessiteaupréalable unmétabolisme
intracellulaireettroisvoiesintra-
Le5-FU oral
cellulairesanaboliquesd’importance
inégale rendentcomptedelacyto-
toxicitédu5-FU (Fig. 1). La capécita-
bine etle tégafur sontdespro-drogues
du5-FU quisontbio-transforméesen
5-FU pardifférentesvoiesmétabo-
liques.Tel qu’ilssontadministrés,leur
profil pharmacodynamiques’apparente
àceluid’une perfusion continuede
5-FU.La capécitabine est uncarba-
matedefluoropyrimidine quitraverse
labarrièreintestinale sansysubirde
dégradation puisest métabolisée au
niveauhépatiqueen5’déoxy-5-fluo-
rocytidine (5’-DFCR)parune car-
boxylestérase,puisen 5’déoxy-5-fluo-
rouridine (5’-DFUR, doxifluridine) par
Objectifspédagogiques
–Connaîtrelesindicationsvalidées;
–Connaîtrelesmodalitésde sur-
veillance;
–Quelle est laréglementation.
Introduction
Utilisédepuislesannéescinquante,le
5-fluorouracil (5-FU)est le plus ancien
médicamentprescritdansle traitement
descancers digestifset,actuellement
encore,undesmédicaments lesplus
prescrits en cancérologie. Le5-FU
appartientàlaclassedesanti-méta-
bolitesde type anti-pyrimidiquedont
le mécanisme d’action principalest de
bloquerlaméthylation de l’uracile en
thymine aboutissantàune inhibition
de lasynthèsedel’ADN [1,2].Ils’agit
d’undérivéfluorédel’uracile,syn-
thétiséen1957parHeidelbergeret
Duschinsky[3].L’activitépharmaco-
logiquedu5-FU nécessiteaupréalable
unmétabolisme intracellulaire. Le
5-FU n’étantpasutilisable parvoie
orale pour desraisonsde mauvaise
biodisponibilitéliée àlaprésencede
dihydropyrimidine déshydrogénase
(DPD)intestinale (enzyme ducatabo-
lisme du5-FU),desprécurseursoraux
du5-FU ontétédéveloppés.Lespro-
grèsinitiaux observésdansle domaine
de lachimiothérapie ducancercolo-
rectalsontle résultatde l’optimisation
de cetancien médicament(schémasde
perfusion continuede5-FU)associée
àlaprescription concomitanted’un
modulateur de son mécanisme d’ac-
tion (l’acide folinique) [4,5].Plus
récemment,l’utilisation de précurseurs
oraux du5-FU amodifié etenrichi les
optionsthérapeutiquesde lapriseen
charge ducancercolorectal,etplus
récemment,ducancergastrique. Deux
précurseurs oraux du5-FU sontactuel-
Th. LECOMTE
(Tours)
Tirésàpart:Thierry Lecomte,Serviced’Hépato-gastroentérologie,CHU de Tours,37044 Tours
cedex9.
5-FUdR 5-FUMP
5-FdUMP 5-FdUDP 5-FUDP
Thymidilate
synthétase 5-FdUTP 5-FUTP
dUMP dTMP
dTTP
ADN ADN ARN
Thymidine
kinase
Thymidine
phosphorylase OPRT
Monophosphate
kinase
Pyrimidine
monophosphate
kinase
Ribonucléotide
réductase
Pyrimidine
diphosphate
kinase
MTHF
PRPP
5-FUH2
5-FUP A
Dihydropyrimidine
déhydrogénase
5-FU
Dihydropyrimidase
Uréidoproprionase
α -fluoro-β -alamine
+CO2 +urée
5-FUH2 :5-fluorohydrouracile
5-FUPA:acide 5-fluorouréidopropionique
5-FudR: 5-fluorodésoxyuridine
5-FdUMP: 5-fluorodésoxyuridine monophosphate
5-FdUDP: 5-fluorodésoxyuridine diphosphonate
5-FdUTP: 5-fluorodésoxyuridine triphosphonate
5-FUMP :5-fluorouridine monophosphate
5-FUDP :5-fluorouridine diphosphate
5-FUTP :5-fluorouridine triphosphate
dUMP: désoxyuridine monophosphate
dTMP: désoxythymidine monophosphate
OPRT :orotate phosphoribosyl transferase
PRPP :phosphoribosyl pyrophosphate
MTHF :5,10-méthyltétrahydrofolate
Figure1.-Métabolisme du5-FU.

Précurseursoraux
du5FU ettraitement
ducancercolorectal
Traitementpalliatif
ducancercolorectal
L’association UFT®/AF etle Xeloda®
en monothérapie ontmontréune acti-
vitééquivalenteàl’association 5-FU
bolus-AF (schémaFUFOL faible Mayo
Clinic)dansle traitementde 1 religne
ducancercolorectalmétastatique
[10-13].Toutefois,cesmédicaments
n’ontpasétécomparésaux schémas
optimisésde 5-FU tel queleLV5FU2,
quiest laréférenceenFrance. Pour
cesdeux médicaments,lacomparai-
son avecle schémaFUFOL aétérap-
portée dansdeux étudesde phaseIII
de grande envergure,randomiséeset
multicentriques,avecdesrésultats
globalementsimilairesen terme
d’efficacité(TableauI). Lessurviesglo-
balesétaientéquivalentesdansles
deux bras.Encequiconcerne lessur-
viessansprogression,une seule étude
évaluantl’association UFT®/AF amis
en évidenceune différencesignifica-
tiveenfaveur dubrasFUFOL [11].Dans
une étude évaluantlacapécitabine,
une différencesignificativedetaux de
réponsesaétérapportée en faveur du
brascapécitabine (24,8%dansle bras
capécitabine versus 15,5%dansle bras
FUFOL faible) [12].Dansl’ensemble de
cesétudes,lesrésultats de tolérance
étaienten faveur desfluoropyrimides
orales(TableauII). Comparéau
brascapécitabine,lasurvenued’une
neutropénie de grade 3-4 étaitsigni-
ficativementplus fréquentedansle
brasFUFOL (21%versus 2%),de
même quelasurvenued’une stoma-
titedegrade 3-4 (15 %versus 2%) et
d’une diarrhée de grade 3-4 (58 %ver-
sus 48 %) [14].Lesyndrome main-pied
étaitparcontreplus fréquentdansle
brascapécitabine (17%degrade 3
versus 0,5%). Leprofil de tolérance
de l’UFT®étaitégalementmeilleur que
celuiduschémaFUFOL avecsignifi-
cativementmoinsde diarrhée,de
muciteetde neutropénie de grade 3-
4. Enrevanche,aucunsyndrome main-
pied de grade 3n’étaitrapportéavec
l’UFT®.La survenued’une hyperbili-
rubinémie liée àune hémolyseest fré-
quentechezlespatients traitéspar
capécitabine ouUFT®.Suiteaux résul-
tats de cesessais,le Xeloda®etl’UFT®
ontobtenul’AMM en Francedansle
traitementducancercolorectalméta-
statique.
Peude donnéesontétérapportéeschez
lessujets âgés.Deux étudesde phase
II évaluantrespectivementl’UFT®et
lacapécitabine chezdespatients âgés
de plus de 70 anssuggèrentune effi-
cacitéetdesprofilsde tolérancecom-
parablesàceux rapportéschezles
patients plus jeunesdanslesétudesde
phaseIII [15,16].
Hormisle classiqueLV5FU2,lesautres
schémasde référencedutraitementdu
cancercolorectalmétastatiquesontdes
associationsde 5-FU optimisé(selon
le schémaLV5FU2le plus souvent)et
d’oxaliplatine (FOLFOX)etd’irinotécan
(FOLFIRI). Lesrésultats despremières
étudesde phaseIII évaluantune fluo-
ropyrimidine orale associée àl’irino-
técanouàl’oxaliplatine viennentd’être
publiés.La majoritédesétudesde
phaseIII actuellementrapportées
concerne l’association capécitabine-
oxaliplatine. Deséquivalencesd’effi-
cacitéentreplusieurs schémasopti-
misésde 5-FU associésàl’oxaliplatine
etl’association capécitabine-oxalip-
tine en 1religne de traitementontété
rapportéesdanstroisétudesde phaseIII
(TableauIII)[17-19].Cestroisétudes
vontdansle sensd’une efficacité
comparable entrelesdifférents bras,
lacytidine désaminasedansle foie et
lestissus tumoraux (Fig. 2)[6].L’étape
finale quiaboutitàlaformation de
5-FU sefaitpréférentiellementau
niveautumoralcarelle est médiée par
lathymidine phosphorylasequiest
surexprimée danslescellulestumo-
rales[7,8].La capécitabine etsesméta-
bolitessontprincipalementéliminés
dansl’urine (95 %deladoseadmi-
nistrée). Lesprincipalesinteractions
médicamenteusesimportantesen pra-
tiquecliniqueconcernentdessubstrats
ducytochrome P450CYP 2C9,princi-
palementlacoumarine etsesdérivés,
ainsiquelaphénytoïne.
La seconde fluoropyrimidine orale dis-
ponible en Franceest composée d’un
précurseur du5-FU, le tégafur,etd’un
substratnaturel de laDPD, l’uracile.
L’absorption digestivedutégafur etde
l’uracile est rapide etcomplète. Letéga-
fur est ensuiterapidementmétabolisé
en 5-FU auniveauhépatiqueparle
cytochrome P450CYP2A6(Fig. 2)[9].
L’uracile permetune inhibition compé-
titivedeladégradation du5-FU par
laDPD, favorisantainsilavoie ana-
boliquedu5-FU, cequiaugmentela
quantitéde5-FU intracellulairedis-
ponible. L’adjonction d’acide folinique
(AF)potentialisel’inhibition compéti-
tivedelathymidylatesynthase(TS)
parle tégafur.Enraison d’unméta-
bolisme essentiellementhépatique,l’in-
suffisancehépatiquesévèreest une
contre-indication àl’UFT®.
114
••••••••
UFT®
Uracile
Tégafur 5FU
DPD
Capécitabine
FOIE
FOIE
INTESTIN
INTESTIN
CYP 2A6
TP
5’-DFUR
5’-DFCR
Capécitabine
5’-DFUR :doxifluridine
5’-DFCR :5’désoxy-5-fluorocytidine
CE :carboxylestérase
CyD :cytidine desaminase
TP :thymidine phosphorylase
CyD
CE
Figure2.-Biotransformationsde lacapécitabine etde l’UFT en 5-FU.

115
••••••••
TABLEAUI
EFFICACITÉ DES PRÉCURSEURS ORAUX DU 5-FU EN MONOTHÉRAPIE DANS LE CANCER COLORECTAL MÉTASTATIQUE :
RÉSULTATSDES ÉTUDES DE PHASE III
NombreTaux de réponseTempsjusqu’àSurvie globale
Auteur Schémade patients objective(%) progression (médiane)
(médiane)
Hoff [10]Capécitabine*302 24,84,3mois12,5mois
FUFOL** 303 15,54,7mois13,3mois
VanCutsem [12]Capécitabine*30126,65,2mois13,2mois
FUFOL** 30117,9(1) 4,7mois12,1mois
Douillard[11]UFT®/AF*** 40911,73,5mois12,4mois
FUFOL** 407 14,53,8mois(2)13,4mois
Carmichael [13]UFT®/AF*** 19010,53,4mois12,2mois
FUFOL 19093,3mois10,3mois
*Capécitabine :1250mg/m2deux foisparjour pendant14 jours suivisparune période de reposde 7jours,J1=J21;** FUFOL faible (MayoClinic):20 mg/m2de
folinatedecalciumsuivispar425mg/m2de 5-FU en IV bolus aux jours 1-5 tous les28jours ;*** UFT®/AF :UFT®300 mg/m2/jentroisprises,associé à90mg/jour
d’AF pendant4semaines,suiviesd’une semaine de repos;(1) :p=0,013;(2):p=0,01.
Hoff [10]VanCutsem [12]Douillard[11]Carmichael [13]
Capécitabine FUFOL Capécitabine FUFOL UFT®/AF FUFOL UFT®/AF FUFOL
Neutropénie 2,6%25,9% 2%19,8% 1% 56%3%31%
Diarrhée 15,4% 13,9% 10,7%10,4% 21% 16%18% 11 %
Mucite3%16%1,3%13,3%1%19% 2%16%
Syndrome main-pied *18,1% 0,7%16,2%0,3%0002%
TABLEAUII
TOLÉRANCE DES PRÉCURSEURS ORAUX DU 5-FU EN MONOTHÉRAPIE DANS LE CANCER COLORECTAL MÉTASTATIQUE :
RÉSULTATSDES ÉTUDES DE PHASE III (TOXICITÉS GRADE 3-4)
*:grade 3.
de même quelesprofilsde tolérance
(TableauIV). Parcontrel’association
capécitabine-irinotécansemble moins
prometteuse. Lesrésultats d’une étude
de phaseIII quicomparaitlesschémas
FOLFIRI, mIFL etCAPERI sonten défa-
veur duschémaCAPERI parrapport
auschémaFOLFIRI en termesde sur-
vie sansprogression etde tolérance
[20].Une autreétude de phaseIII qui
comparaitle schémaFOLFIRI au
schémaCAPERI aétéinterrompuepré-
maturémenten raison d’untaux élevé
de décèsdansle brasCAPERI [21].A
noterquedanscesdeux études,les
patients étaientégalementrandomi-
sésentreplaceboetcelecoxib.
Une étude randomisée de stratégie qui
comparaitdeux séquencesde traite-
ments àbasedecapécitabine aété
publiée cetteannée (séquenceA:
capécitabine puisirinotécanpuiscapé-
citabine-oxalipatine ;séquenceB:
capécitabine-irinotécanpuiscapécita-
bine- oxaliplatine) [22].Lecritèrede
jugementprincipalétaitlasurvie
globale et820 patients ontétéinclus
danscetteétude. Comme on pouvaits’y
attendre,il existaitunavantage en
termesde taux de réponseobjectiveet
de survie sansprogression avecla
séquencebithérapie d’emblée (taux de
réponseobjective:20 %versus 41 %,
p<0,0001;survie sansprogression
de la1 religne de traitement:5,8mois
versus 7,8mois,p<0,0002),maisles
médianesde survie globale n’étaient
passignificativementdifférentesentre
les2bras(16,3moisdansle bras
séquentiel Aversus 17,4moisdansle
brasséquentiel B).
Aucune étude de phaseIII évaluant
une association àbased’UFT®n’aété
rapportée àcejour,maisdesétudes
concordantesde phaseII ontmontré
l’intérêtpotentiel desassociations
UFT®/oxaliplatine etUFT®/irinotécan
[23,24].
Comptetenude cesrésultats,le
meilleur schémaàbased’irinotécan
dansle traitementducancercolorectal
métastatiqueresteleFOLFIRI alors que
le schémaXELOX peut êtreune alter-
nativeàunschémade type FOLFOX.
Une étude plus récentequiainclus
2034patients aévalué,d’une part la
non inférioritéduschémaXELOX par
rapport auschémaFOLFOX4et,
d’autrepart,lasupérioritéde
l’adjonction de bévacizumab àune
chimiothérapie àbased’oxaliplatine
(XELOX+bévacizumab 7,5mg/kg/3
semainesouplaceboversus FOL-
FOX+bévacizumab 5mg/kg/2 semai-
nesouplacebo) [25,26].L’objectif
principalétaitlasurvie sansprogres-
sion. Danscetteétude,lanon-
inférioritéduschémaXELOX par
rapport auschémaFOLFOX aété
démontrée en termesde survie sans
progression etde survie globale,et
l’adjonction dubévacizumab amène
unallongementsignificatif (1,4mois)
de lasurvie sansprogression. La plu-
part desessaisde phaseIIIactuelle-

116
••••••••
NombreTaux de réponseTempsjusqu’àSurvie globale
Auteur Schémade patients objective(%) progression (médiane)
(médiane)
Diaz-Rubio [17]XELOX* 17137 8,9mois18,1mois
FUOX** 171489,5mois20,8mois
Porschen [18]CAPOX*** 239487,1mois16,8mois
FUFOX**** 231548mois18,8mois
Ducreux [19]FOLFOX6***** 150428,8mois19,9mois
XELOX* 156469,3mois20,5mois
Cassidy[26]XELOX +/–1017–8mois19,8mois
bévacizumab
FOLFOX4+/-1017–8,5mois19,6mois
bévacizumab
Fuschs[20]FOLFIRI §144 47,27,6mois23,1mois
mIFL §§ 14143,35,9mois17,6mois
CapeRI §§§ 145 38,65,8mois18,9mois
TABLEAUIII
EFFICACITÉ DE LA CAPÉCITABINE ASSOCIÉE ÀL’OXALIPLATINE OU ÀL’IRINOTÉCAN DANS LE TRAITEMENT
DU CANCER COLORECTAL MÉTASTATIQUE :RÉSULTATSDES ÉTUDES DE PHASE III
*:XELOX :capécitabine 1000 mg/m22foisparjour pendant14 jours etoxaliplatine 130 mg/m2àJ1,J1=J21.
** :FUOX :5-FU 2250mg/m2en perfusion continuede48heuresàJ1,J8,J15,J22,J29etJ36 etoxaliplatine 85 mg/m2àJ1,J15 etJ29toutesles6semaines.
*** :CAPOX :capécitabine1000 mg/m22foisparjour de J1àJ14 etoxaliplatine 70 mg/m2àJ1etJ8,J1=J21.
**** :FUFOX :oxaliplatine 50mg/m2,AF500 mg/m2,5-FU 2000 mg/m2en perfusion continuede22 heuresàJ1,J8,J15 etJ22,J1=J36.
***** :FOLFOX6:LV5FU2simplifié etoxaliplatine 100 mg/m2,J1= J14.
§:FOLFIRI :irinotécan180mg/m2,AF400 mg/m2,5-FU 400 mg/m2en bolus,5-FU 2400 mg/m2en perfusion continuede46heures(J1=J14).
§§ :mIFL :irinotécan125mg/m2,AF20 mg/m2et5-FU bolus 500 mg/m2àJ1etJ8(J1=J21).
§§§ :CAPERI :irinotécan250mg/m2àJ1,capécitabine 1000 mg/m2deux foisparjours de J1àJ14 (J1=J21).
Diaz-Rubio [17]Porschen [18]Ducreux [19]Cassidy[26]Fuschs[20]
XELOX FUOX CAPOX FUFOX XELOX FOLFOX6XELOX FOLFOX4CapeRI mIFL FOLFIRI
Neutropénie 7%11% 7%7%5%47%6%43%32 %41% 43%
Diarrhée 14 %24% 15 %14% 13%7%20 %11% 47%19% 14 %
Mucite2%4%1%3%– –1%2%– ––
Neuropathie 18 %16%25% 30 %11% 25% 4% 4% –––
Syndrome 2%1%10%*4%*3%1%14%*3%*10%00
main-pied
TABLEAUIV
TOLÉRANCE DE LA CAPÉCITABINE ASSOCIÉE ÀL’OXALIPLATINE OU ÀL’IRINOTÉCAN DANS LE TRAITEMENT
DU CANCER COLORECTAL MÉTASTATIQUE :RÉSULTATSDES ÉTUDES DE PHASE III (TOXICITÉS GRADE 3-4)
*:grade 2-3.
menten cours danslesquelssont
évaluéesdesthérapiescibléesasso-
ciéesaux chimiothérapies«clas-
siques»,comprennentdesbrasde
traitementavecdesassociationsà
basedefluoropyrimidinesorales.
Traitementadjuvantducancer
ducôlon
Lesrésultats de l’évaluation de lacapé-
citabine dansle traitementducancer
colorectalmétastatiqueontjustifié sa
comparaison auschémaFUFOL dans
le cancerducôlon de stade III.L’objectif
principaldel’étude randomisée X-act,
quiacomparélacapécitabine au
schémaFUFOL MayoClinicpendant
24semaines,étaitde montrer«au
moins»une équivalenceenterme de
survie sansévènemententreces2sché-
masde traitement[27].Avecunsuivi
médiande3,8ans,l’objectif principal
de l’étude quiainclus 1987patients
aétéatteintetlasurvie sansrechute
étaitmême significativementsupérieure
dansle brascapécitabine (p =0,04).
Demême,latoléranceautraitement
étaitsignificativementmeilleuredans
le brascapécitabine. Cetraitementoral
est une option recommandée chezles
patients justiciablesd’une chimiothé-
rapie adjuvanteparl’association 5-
FU/AF.
Unautreessaiadjuvantd’équivalence
quiacomparéleschémaFUFOL faible
àl’association UFT®/AF chezdes
patients traitéspour uncancerdu
côlon de stade II ouIII amontréque
lessurviessansprogression etglobale

danslesdeux bras.Letaux de réponse
complèteanatomopathologiqueétait
de 13,4%danslesdeux brasetle taux
de résécabilitéde92%dansle bras
UFT®/AF versus 93%dansle bras
FUFOL (différencenon significative). Le
taux de downstaging (objectif secon-
daire) étaitsignificativementplus élevé
dansle brasUFT®/AF (59,2%versus
43,3%;p=0,04). Destoxicitéshéma-
tologiquesde grade 3-5 étaientseule-
mentobservéesdansle brasFUFOL
(taux de leucopénie de grade 3-5 :9%;
p=0,02). Desétudesquiévaluentla
radiothérapie associée de façon conco-
mitanteàdesbi-outrithérapiesàbase
de fluropyrimidine orale (plus oxali-
platine ouirinotécan,voireégalement
plus cétuximab oubévacizumab)sont
actuellementen cours danscetteindi-
cation aveclaperspectived’améliorer
lestaux de réponse[32,33].
Précurseursoraux
du5-FU ettraitement
descancers
œso-gastriques
Lesfluoropyrimidinesoralesoccupent
égalementune placeimportantedans
le traitementducancergastriqueavec
desrésultats récents quivontencore
accroîtreleur placedanslapriseen
charge de cetype de cancer.Ungrand
essaidenon inférioritéquicomparait
parpairesdespatients traitésparune
association àbasede5-FU oude capé-
citabine etdespatients traitésparune
association de cisplatine oud’oxali-
platine aétérécemmentpublié [34].
Lesschémasévaluésétaient:ECF (épi-
rubicine,cisplatine,5-FU),EOF (épi-
rubicine,oxaliplatine,5-FU),ECX (épi-
rubicine,cisplatine,capécitabine),EOX
(épirubicine,oxaliplatine,capécita-
bine). Lesdosesétaientlessuivantes:
épirubicine 50mg/m2toutesles3se-
maines,cisplatine 60 mg/m 2toutesles
3semaines; oxaliplatine 130 mg/m2
toutesles3semaines;5-FU 200 mg/m 2
IV parjour en continuetcapécitabine
625mg/m 2deux foisparjour parvoie
orale en continu.Cetteétude ainclus
1002 patients atteints majoritairement
d’unadénocarcinome gastriqueou
de l’œsophage (90%despatients).
étaientéquivalentesdanslesdeux bras,
avecdesprofilsde tolérancecompa-
rables[28].
Lesrésultats de toléranced’une étude
quiacomparéleschémaXELOX au
schémaFUFOL àtitreadjuvantchez
despatients opérésd’uncancerdu
côlon de stade III, montrentquele
schémaXELOX induitmoinsde toxi-
citédigestiveethématologiquede
grade 3-4 queleschémaFUFOL [29].
Parcontre,le schémaXELOX est
associé àplus de toxicitésévère
neurologiqueetde syndrome main-
pied. Ilest probable quelesrésultats
desétudesen cours,quiévaluentle
schémaXELOX en adjuvant,mon-
trentune équivalenceentrece
schémaetle schémaFOLFOX4dans
cetteindication,etqueceschéma
devienne une option recommandée
chezlespatients justiciablesd’une
chimiothérapie adjuvantepar
FOLFOX4.
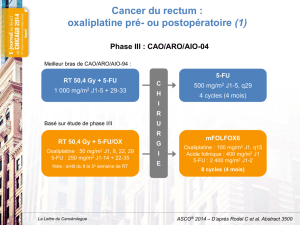
Radio-chimiothérapie
etcancerrectum
La chirurgie précédée d’une radiochi-
miothérapiepré-opératoireest le trai-
tementstandarddescancers durectum
T3/T4et/ouN+[30].La chimiothéra-
pie concomitanterecommandée est le
schémaFUFOL bolus (une cureaux
semaines1et5). Lesalternativesles
plus souventutiliséesde ceschéma
sontle LV5FU2,le 5-FU continuet,
plus récemment,lesfluoropyrimides
orales.Lesétudesde phaseII rappor-
téessonten faveur d’une toléranceet
d’une efficacitéacceptablesd’une asso-
ciation de radiochimiothérapie àbase
de capécitabine oud’UFT®dansle trai-
tementnéo-adjuvantducancerdu
rectum. La plupart desessaisde radio-
chimiothérapie néo-adjuvanteactuel-
lementen cours dansle cancerdu
rectum,évaluentdesschémasde trai-
tementàbasedefluoropyrimidine
orale. La premièreétude de phaseIII de
radiochimiothérapie néo-adjuvante
dansle cancerdurectumvientd’être
publiée [31].Elle acomparéleschéma
FUFOL àl’association UFT®/AF (UFT®:
300 mg/m2matin etsoirpendant
4semaines). Lescritèresde jugement
étaientle taux de réponsecomplèteet
larésécabilitéquiétaientcomparables
L’objectif de l’étude étaitde comparer
lespatients traitésparune fluoropy-
rimidine (ECF +EOF versus ECX +
EOX)etlespatients traitésparunsel
de platine (ECF +ECX versus EOF +
EOX). Lecritèred’évaluation princi-
palétaitlasurvie globale. Lesmédianes
de survie globale danslesbrasECF,
ECX, EOF etEOX étaientrespective-
mentde 9,9mois,9,9mois,9,3mois
et11,2mois.Lesrésultats de l’analyse
principale montrentquelacapécita-
bine n’est pasinférieureau5-FU et
quel’oxaliplatine n’est pasinférieur
aucisplatine. La médiane de survie
globale despatients traitésparEOX
étaitsignificativementsupérieureà
celle despatients traitésparECF
(p =0,02). Lestaux de réponsesdans
lesbrasECF,ECX, EOF etEOX étaient
comparables,respectivementde 41 %,
46%,42%et48 %. Une autreétude
dansle cancergastriqueavancéamon-
tréquel’association capécitabine/
cisplatine étaitéquivalenteàlaclas-
siqueassociation 5-FU/cisplatine
(schémamensuel FUP)[35].Toutefois,
le schémaFUP n’est plus considéré
comme unstandardenFrancecontrai-
rementauschémaLV5FU2-platine
dontlatoléranceest meilleure. Les
résultats de cesétudesontpermisàla
capécitabine d’obtenirl’AMM en 1re
ligne dansle traitementducancergas-
triqueavancé,en association àune
chimiothérapie àbasedesel de pla-
tine. Leremplacementdu5-FU continu
parlacapécitabine dansle classique
schémade référenceanglo-saxon ECF
vapermettreune diffusion plus large
de cetype de schéma, quiest égale-
mentune référencedansle traitement
néo-adjuvantducancergastriqueloca-
lisé[36].L’association docétaxel/capé-
citabine aétéévaluée dansplusieurs
étudesde phaseII en 1 religne de trai-
tementducancergastriqueavancé
avecdestaux de réponsesupérieurs à
40%danslaplupart desétudes,avec
cependantune toxicitéhématologique
importanteetuntaux élevédesyn-
drome main-pied de grade 3[37,38].
Enfin,danslespays asiatique,le S1
connaîtundéveloppementimportant
dansle cancergastriqueavecnotam-
mentune étude récenteenfaveur de
son efficacitédansle traitementadju-
vantducancergastriquecomparéàla
chirurgie seule [39].
117
••••••••
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%