Sujet 3 - Formation des nuages

3-1
Sujet 3 - Formation des nuages
1 - Qu'est-ce un nuage? .......................................................................................................1
2 - Changements de phase...................................................................................................1
3 - Relations quantitatives de définition de l’humidité de l’air...........................................3
4 - Causes de refroidissement..............................................................................................8
5 - Les sources de mouvement vertical .............................................................................11
Profil de température.................................................................................................13
Température potentielle.............................................................................................18
Température potentielle équivalente.........................................................................19
Température du thermomètre mouillé.......................................................................19
7 - La stabilité et le temps qu’il fait...................................................................................20
8 - Mouvement Vertical Orographique.............................................................................20
9 - Mouvement vertical associé aux dépressions et aux fronts .........................................22
En observant le changement du temps au jour le jour certaines questions se posent:
Qu'est-ce qu'un nuage? Qu'est-ce que l'humidité? Comment et pourquoi se forment les
nuages? Pourquoi présentent-ils des formes si variées?
1 - Qu'est-ce un nuage?
Chacun sait que la partie visible des nuages est composée de gouttelettes ou de cristaux
de glace de faibles dimensions en suspension dans l'air.
Les nuages sont donc constitués de fines particules d'eau assemblées à l'état liquide
(nuages de gouttelettes) ou à l'état solide (nuages de cristaux de glace ou de neige) en
masses d'épaisseur, d'étendues et de formes variables qui flottent dans l'atmosphère. Leur
couleur est due à la diffusion par les particules composant le nuage de tous les rayons
visibles incidents provenant du Soleil ou de la Lune et aussi du ciel et du sol.
2 - Changements de phase
Mais quels mécanismes sont à l'origine de la formation de ces gouttelettes? Les processus
de formation des nuages sont complexes et très variés mais ils amènent toujours à la
condensation ou solidification de la vapeur d'eau. Les changements de phase (vapeur
d'eau à l'eau liquide, l'eau à la glace, etc.) ont des rôles primordiaux dans la formation
des nuages.
La vapeur d'eau est un gaz inodore et incolore qui se mélange librement avec d'autres gaz.
Au contraire de l'oxygène, de l'azote et autres, aux températures rencontrées dans notre
atmosphère, la vapeur d'eau peut exister en trois phases (liquide, vapeur, glace) aux
températures et pressions caractéristiques de la surface de la Terre. L'air le plus limpide
contient toujours de la vapeur d'eau même s'il ne constitue qu'une infime fraction. Son
pourcentage varie de 0 à 4 % par volume. Mais son importance pour la météorologie est
bien plus important que son pourcentage...
Les changements de phase possibles sont:

3-2
vapeur ‹—————› liquide (condensation, évaporation)
liquide ‹—————› solide (solidification, fusion)
vapeur ‹—————› solide (condensation solide, sublimation)
Pendant un changement de phase, il y a absorption ou dégagement de chaleur. Dans la
formation des nuages, les mécanismes les plus importants sont la condensation, la
solidification et la condensation solide: il s'agit de changements qui vont dans la direction
d'une augmentation de l'ordre moléculaire pendant lesquels il y a dégagement de chaleur.
Figure 3-1
L'unité de mesure de la chaleur est le Joule (J); 4,1868 J est la quantité de chaleur
nécessaire pour augmenter de 1°C la température de 1 gramme d'eau pure (on définissait
autrefois la calorie comme unité de mesure de la chaleur; il fallait une calorie pour
augmenter de 1°C la température de 1 gramme d'eau pure). En certaines conditions, un
corps peut absorber ou dégager de l'énergie sans changement de sa température. Par
exemple, si on fournit de la chaleur à une masse de glace (0 °C), la température reste
constante jusqu'à que toute la glace soit fondue. Où va cette chaleur? Dans ce cas, la
chaleur est utilisée pour rompre la structure cristalline interne de la glace. Puisque cette
chaleur ne provoque pas un changement de température, on l'appelle chaleur latente.
Cette énergie sera dégagée si jamais le liquide se re-solidifie. La chaleur latente joue un
rôle très important dans le déroulement de certains phénomènes atmosphériques.
Évaporation: Passage de l'état liquide à l'état gazeux. Il faut 2,5008.106 J pour convertir
un kilogramme d'eau liquide en un kilogramme de vapeur d'eau. Cette énergie est utilisée
pour augmenter l'énergie cinétique des molécules d'eau qui auront à traverser la barrière
d'énergie que constitue la surface du liquide. C'est la chaleur latente d'évaporation. S'il
n'y a pas d'apport d'énergie extérieur, ce sont les molécules d'eau les plus énergétiques qui
s'échapperont de la surface liquide. Ainsi, l'énergie cinétique moyenne des molécules (la

3-3
température) qui restent diminue. L'évaporation est un processus que provoque le
refroidissement de l’environnement.
Condensation: C'est le processus inverse de l'évaporation c'est à dire le passage de l'état
gazeux à l'état liquide. Dans ce changement de phase, il y a dégagement de chaleur
latente.
Fusion: Changement de l'état solide à l'état liquide. L'énergie nécessaire pour détruire la
structure cristalline d'un kilogramme de glace est de 0,3337.106 J.C'est la chaleur latente
de fusion.
Solidification: C'est le processus inverse de la fusion c'est à dire le passage de l'état
liquide à l'état solide. Dans ce changement de phase, il y a dégagement de chaleur latente.
Sublimation: C'est le terme qui désigne le changement de l'état solide à l'état gazeux sans
passer par l'état liquide. Le coefficient de chaleur latente de sublimation est de 2,8345.106
J par kilogramme. A noter que la chaleur latente de sublimation est égale à la chaleur
latente d'évaporation plus la chaleur latente de fusion.
Condensation solide:. C'est le processus inverse de la sublimation c'est à dire le passage
de l'état gazeux à l'état solide. Dans ce changement de phase, il y a dégagement de
chaleur latente.
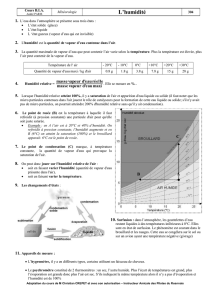
3 - Relations quantitatives de définition de l’humidité de l’air
L'humidité : C'est le terme utilisé pour décrire la quantité de vapeur d'eau dans l'air. On
utilise plusieurs méthodes pour exprimer de façon quantitative cette grandeur. Entre
autres: l'humidité absolue, le rapport de mélange, et l'humidité relative. Mais avant de
considérer chacune de ces définitions, il est important de comprendre le concept de
saturation.

3-4
Lutgens et Tarbuck 1986
Figure 3-2: Illustration schématique de la pression de vapeur et de la
saturation

3-5
Imaginons un contenant fermé rempli à moitié d'eau et à moitié d'air sec (voir figure ci-
dessus). On sait que la température est la mesure de l'énergie cinétique des molécules.
Puisque l’eau a une température supérieure au zéro absolu (supérieure à 0° K, -273° C),
les molécules d'eau sont en mouvement permanent. Les plus énergétiques vont réussir à
rompre les liens qui les unissent aux autres molécules d'eau et vont s'échapper en forme
de vapeur d'eau. C'est l'évaporation.
Au fur et à mesure que l'eau s'évapore on détecte une faible augmentation de pression de
l'air au-dessus de la surface d'eau. Cette augmentation est due au mouvement des
molécules d'eau qui se sont additionnées à l'air par évaporation. Dans l'atmosphère, cette
pression due à la présence de la vapeur d'eau est appelée pression ou tension de vapeur.
La tension de vapeur est définie comme la fraction de la pression atmosphérique totale
attribuée à la présence de vapeur d'eau.
Les molécules d'eau qui existent dans l'air ne sont pas au repos. Un certain nombre frappe
la surface libre du liquide et réintègre l'eau, c'est à dire passe de l'état gazeux à l'état
liquide. Plus il y a de molécules d'eau dans l'air plus il y en aura qui retourneront à l'état
liquide. À un moment donné, le nombre de molécules qui passe à l'état de vapeur est égal
au nombre de molécules qui passe à l'état liquide. A ce moment, l'air est dit "saturé" ce
qui veut dire que le nombre de molécules de vapeur d'eau que l'air contient ne varie plus.
Le système est en équilibre. Quand l'air est saturé la pression partielle exercée par la
vapeur d'eau est appelée pression (ou tension) de vapeur saturante.
Cependant, si on augmente la température de l'eau du contenant, les molécules ont plus
d'énergie et une plus grande quantité d'eau s'évapore avant d'atteindre l'équilibre entre les
deux phases. Par conséquent la pression (ou tension) de vapeur saturante dépend de la
température et augmente avec celle-ci, ce qui veut tout simplement dire qu'à des
températures plus élevées il doit y avoir plus de vapeur d'eau dans l'air pour que celui-ci
soit saturé. On peut maintenant mieux apprécier les différences entre les méthodes les
plus familières pour mesurer le contenu de vapeur d'eau dans l'air.
Humidité spécifique: décrit la proportion de vapeur d’eau dans le mélange d’air humide.
(normalement grammes de vapeur d'eau par kilogramme d’air).
q = mv
mv + md(3-1)
où m
v
est la masse de vapeur d'eau et m
d
la masse d'air sec dans une unité de volume d'air.
Humidité absolue: c’est la masse de vapeur d’eau par unité de volume d’air, les unités
étant grammes par mètre cubique. Correspond à la densité partielle de la vapeur d’eau
dans une parcelle d’air de masse dv mmm += .
()
V
mv
p
v=ρ
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%