10-mecanismes-d-action-des-anti-infectieux

MECANISMES D’ACTION DES MEDICAMENTS ANTI-INFECTIEUX
MECANISMES D’ACTION DES ANTIBIOTIQUES
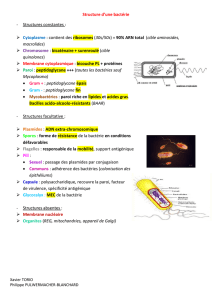
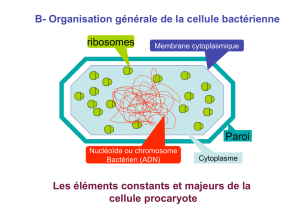
Structure des
bactéries
Les deux types de paroi (Gram positif et Gram négatif) possèdent une structure commune qui forme un réseau autour de la membrane plasmique: le peptidoglycane (= muréine) constitué d’une partie glucidique
et d’une partie peptidique.
Gram +
Gram -
Peptidoglycane :
- Epais (jusqu’à 80 nm d’épaisseur)
- Forme un réseau serré
- Présence d’acides téchoïques, acides à longues chaînes, qui le traversent
Pas de membrane externe
Peptidoglycane :
-Très fin, (taille moyenne de quelques nm)
- Plus relâché que chez les Gram +
Présence d’une membrane externe
-Délimite, avec la membrane plasmatique, l’espace périplasmique qui contient de nombreuses enzymes.
-Double couche phospholipidique incluant des protéines (des porines pour le passage des nutriments, par
exemple)
-Contient une molécule particulière : le lipopolysaccharide (LPS) ou Endotoxine
-LPS : partie lipidique ancrée dans la membrane externe + partie glucidique orientée vers l’espace
extracellulaire
-Parfois la membrane externe peut être surmontée de grandes molécules polysacharidiques formant une
capsule ou un « slime »
Les différentes
cibles des
antibiotiques
Synthèse de la paroi (peptydoglycanne)
Transcription de l’ADN
Synthèse des protéines
Synthèse des acides nucléiques

ANTIBIOTIQUES INHIBANT LA SYNTHESE DE LA PAROI BACTERIENNE (PEPTYDOGLYCANNE)
Etapes intra-cytoplasmiques
Etapes membranaire
Etapes périplasmiques (élongation du peptidoglycane)
BETALACTAMINES
GLYCOPEPTIDES
FOSFOMYCINE
•Possèdent une analogie de structure avec le substrat des transpeptidases et des carboxypeptidases (structure D-
alanine/D-alanine). Ces enzymes ont reçu le nom de « protéines liant la pénicilline » (PLP ou PBP en Anglais)
• Perturbent la structure de la paroi cellulaire bactérienne, en particulier les formes Gram positif.
•Déstabilise osmotiquement la membrane cytoplasmique de la bactérie.
•Les bactéries Gram négatif ne possèdent pas de paroi cellulaire protéique mais possèdent une ou plusieurs PLP
intégrées dans la membrane cytoplasmique et jouant un rôle dans sa synthèse.
•Effet bactériostatique : liaison covalente à la transpeptidase, inhibant la synthèse du peptidoglycane formation de
sphéroplastes
•Effet bactéricide : activation successive d’enzymes lytiques appelés autolysines éclatement de la cellule
•Effets d’autant plus important que les bactéries sont en phase de multiplication (avec synthèse active de la paroi) et
que leur nombre est moins élevé
Très grosses molécules (PM élevé)
Ne peuvent pas passer les porines pas d’action sur des bactéries Gram –
•La cible des glycopeptides est l’unité disaccharide-pentapeptide =
précurseur du peptidoglycane
•Agissent par une reconnaissance « clé/serrure » des motifs D-Ala-D-Ala
•L’antibiotique fixé à ce motif bloque les PLP par encombrement stérique
pour former un complexe stable et entraîner une inhibition de l’élongation
du peptidoglycane
Action au niveau du cytoplasme
Emprunte la voie des hexoses
phosphates pour entrer dans la cellule
Inhibition de la 1ère étape de la
synthèse du peptidoglycane catalysée
par la UDP-N-acetylglucosamine
enolpyruvyl transferase = MurA (=
cible)
•Le nombre des PLP varie selon les espèces bactériennes (elles sont désignées par ordre décroissant de poids
moléculaire)
•L’effet dépend de l’affinité de la bétalactamine aux différentes PLP (= Cibles)
•L’effet dépend de la concentration en bétalactamine au contact avec les PLP
- si concentrations faibles : chaque bétalactamine ayant une affinité préférentielle différente vis-à-vis de
chacune des PLP, l’affinité sera maximale vis-à-vis de sa cible essentielle
- si concentrations élevées: d’autres PLP moins affines pourront être inhibées
•La concentration en bétalactamine dépend elle-même
-de sa capacité à pénétrer dans la cellules
la pénétration des bétalactamines est aisée à travers le peptidoglycane (atteinte aisée des cibles dans les
bactéries Gram+)
la pénétration est plus difficile à travers la membrane externe et dépend des porines (atteinte variable des
cibles dans les bactéries Gram -)
-des mécanismes d’élimination ou dégradation de la bétalactamine dans la cellule bactérienne
INHIBITEURS DE LA TRANSCRIPTION DE L’ADN
INHIBITEUR DE SYNTHESE DES PROTEINES
Les quinolones et fluoroquinolones
Rifamycine (Rifampicine)
Aminoside Gentamicine ®
Macrolide
Clarithromycine ®
Tétracycline
Doxicycline
Oxazolidinones
Linezolide
Inhibent de manière sélective la réplication de
l’ADN bactérien en agissant au niveau des
surenroulements
Touchent deux types d’enzymes impliquées:
- l’ADN gyrase (enroule l’ADN)
- la topoisomérase IV (déroule l’ADN)
Les quinolones touchent la gyrase → limité aux
Gram–
Les fluoroquinolones touchent la gyrase + la topo IV
→ Gram – et Gram +
Ces enzymes se lient à l’ADN et le complexe enzyme-
ADN est reconnu par l’antibiotique qui s’y fixe et
stabilise ce complexe au moment où l’ADN est déjà
clivé. Si les deux éléments sont seuls il n’y a pas d’effet.
Interfère avec la
transcription de l’ADN en
inhibant l’ARN-polymérase
dépendante de l’ADN.
Supprime la formation
initiale de la chaîne d’ARN
et non l’arrêt de son
élongation.
•Substances hydrophiles polycationiques de type « sucres aminés »
qui doivent pénétrer à l’intérieur de la cellule pour être actives.
-Se lient à des molécules de charge négative situées sur la
membrane externe d’organismes Gram négatif par un processus
passif
-Pénètrent dans le périplasme par diffusion via les canaux
membranaires (porines).
-Sont ensuite transportés à travers la membrane cytoplasmique
vers le cytosol, par processus actif (nécessitant de l’énergie).
•Se lient alors à l’ARNr 16S, formant des composés qui se fixent par
la suite au site de décodage de l’ARNt aminoacylé, de la sous-unité
30S des ribosomes.
•Ce processus interfère avec la reconnaissance de l’ARNt par
l’ARNr lors de la traduction conduisant à la synthèse de peptides
aberrants, dont ceux destinés à la membrane plasmique.
•Ils se fixent au niveau de
la sous unité 50s du
ribosome et empêchent
l’activité de la peptidyl-
transférase nécessaire à
l’élongation des
protéines.
•Agissent par
encombrement stérique.
•Pénétration par
diffusion passive en se
fixant aux ions Mg2+ de
la membrane Fixation
réversible sur le
ribosome 30S =>
blocage de synthèse
peptidique
•Inhibent également la
synthèse protéique des
mitochondries en se
liant à la sous-unité 70S
du ribosome
•Mécanisme mal
connu : inhibition
protéique à un stade
précoce.
•Se lient à l’unité 50S
du ribosome, et
empêche la
formation du
complexe 70S. Il
semble que le centre
de la
peptidyltransférase
ribosomique soit
leur site d’activité
principal. Inactives
chez les Gram –
INHIBITEUR DE SYNTHESE DES ACIDES NUCLEIQUES
Sulfamides antibactériens et inhibiteurs de dihydrofolate réductase : Sulfaméthodaxole et trimetoprime
Inhibition de la synthèse de l’acide folique nécessaire à la synthèse des bases puriques et pyrimidiques
Les bactéries ne peuvent assimiler l’acide folique exogène Synthèse intracellulaire obligatoire par l’utilisation de 3 constituants élémentaires : l’acide par-amino benzoique, l’acide glutamique et la ptéridine.
L’assemblage est permis par la dihydrofolate synthétase qui est inhibée par le sulfaméthoxazole.
Par la suite, l’acide folique est réduit en tétrahydrofolate par une dihydrofolate réductase qui est elle-même inhibée par le triméthoprime
Sulfamétoxazole et triméthoprime sont séparément bactériostatiques mais bactéricides ensemble : il y a synergie.

Mécanismes d’action des antiviraux
Grande
diversité de
structure
des virus
Structure commune aux virus :
Enveloppe lipidique + capside
Matériel génétique différent :
ADN ou ARN, mono ou bicaténaire
Mécanisme
INHIBITION DE L’ADN POLYMERASE
INHIBITION DE LA SYNTHESE
NUCLEOSIDIQUE
VIRUS A ARN : NOMBREUSE CIBLES THERAPEUTIQUES
INHIBITEUR DE
NEURAMINIDASE
Molécule
Aciclovir
Famciclovir
Ganciclovir
Cidofovir
Adefovir
Ribavirine
Mycophénolate
mofetil
Oseltamivir
Rôle
Analogues nucléosidiques
nécessitant une
phosphorylation virale
Analogue
nucléotidique
actif après double
phosphorylation
par la cellule hôte
Inhibe
sélectivement les
ADN polymérase
des HSV I, HSV II
et CMV
Analogue
nucléotidique de
l'adénosine
monophosphate
Inhibe de
manière
compétitive l’ADN
polymérase du
virus de l’hépatite
B après avoir été
phosphorylé par
des enzymes
cellulaires.
inhibiteurs de l’IMP déhydrogénase
nécessaire à la synthèse de GMP et
GTP, dGTP impliqués dans la
formation de l’ADN et l’ARN
HIV :
- Inhibiteur deco-récepteur
Maraviroc = antagonistes du récepteur CCR5,
empêchant ainsi le VIH-1 à tropisme CCR5 de pénétrer
dans les cellules.
- Inhibiteur de fusion
Enfuvirtide = inhibiteur du réarrangement structural de
la gp41 du VIH-1, bloquant ainsi la fusion entre la
membrane virale et la membrane de la cellule cible, et
empêchant l'ARN viral d'entrer dans la cellule cible.
- Inhibiteur d’intégrase
Raltegravir = empêche l'insertion covalente, ou
intégration, du génome du VIH dans le génome de la
cellule hôte
- Inhibiteur de transcriptase inverse
Tenofovir = Inhibe la transcriptase inverse du VIH-1 et
la polymérase du VHB par liaison compétitive directe
avec le substrat désoxyribonucléotidique naturel et
après incorporation dans l'ADN au niveau de la
terminaison de la chaîne d'ADN.
- Inhibiteur de protéase
Atazanavir = bloque sélectivement la synthèse du
précurseur polyprotéique viral gag-pol dans les cellules
infectées par le VIH-1, empêchant ainsi la formation de
virions matures et l'infection d'autres cellules.
Virus de l’hepatite
C :
Inhibiteur de
réplicase :
Valopicitabine, =
Inhibe l’élongation de
l’ARN
Inhibiteurs de
protéase :
Eboceprevir =
inhibe la réplication
virale dans les
cellules hôtes
infectées par le VHC.
Empêche au virus
de pénétrer dans
les cellules non
infectées
Empêche la
libération des
particules virales
nouvellement
formées des
cellules infectées et
la propagation du
virus dans
l'organisme.
Mécanismes d’action des antifongiques
INHIBITION DE LA SYNTHESE DE L’ADN ET DE L’ARN
INHIBITION DES FONCTIONS LA PAROI PAR INTERACTION AVEC
L’ERGOSTEROL
ALTERATION DE LA MEMBRANE PAR INHIBITION
DE LA SYNTHESE D’ERGOSTEROL
ALTERATION DE LA PAROI FONGIQUE
PAR INHIBITION DE LA SYNTHESE DE
D-GLYCANE
Flucytosine = 5-fluoro-cytosine
Polyènes
(Amphotéricine B, nystatine)
Azolés (ex : voriconazole)
Formation de 5-Flurorouracil par la cytosine
déaminase fongique
Effets antimétaboliques (inhibe la synthèse d’ADN et
ARN)
•Interagit avec l'ergostérol présent dans la membrane des levures et des
champignons nécessaire à l’intégrité de la membrane cellulaire et à la
formation de pores ou de canaux.
•Entraîne une dépolarisation de la membrane et une augmentation
de sa perméabilité avec perte du contenu cytoplasmique. La fuite des
ions K+, Na+ et H+ et des molécules intracellulaires altère la viabilité
cellulaire, entraînant la mort de la cellule fongique
•Inhibition de l’isoenzyme lanostérol 14α-
déméthylase du cytochrome P450 de la cellule
fongique.
•Empêche la conversion du lanostérol en ergostérol,
élément essentiel au maintien de l’intégrité de la
membrane cellulaire fongique.
•Inhibiteurs de la synthèse du β-(1,3)
D-glucane, composé essentiel de la
paroi cellulaire de plusieurs
champignons pathogènes
•Brisent l’intégrité structurale de la
paroi cellulaire et entraînent un
déséquilibre osmotique puis la lyse de la
cellule fongique.

1
/
4
100%