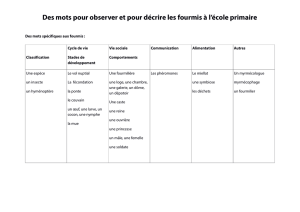
les fourmis de la forêt boréale du québec

LES FOURMIS DE LA FORÊT BORÉALE DU QUÉBEC
(FORMICIDAE, HYMENOPTERA)
RÉSUMÉ
Les données d’échantillonnage, accumulées depuis plus de 30 ans, sur les fourmis de la forêt
boréale du Québec, telle que délimitée par Richard (1995), permettent de dresser le portrait
suivant: un répertoire de 36 espèces, regroupées dans huit genres et trois sous-familles de la
famille des Formicides (Hyménoptères). Le tableau 1 donne la liste de ces taxons en fonction de
trois partitions du biome de la forêt boréale. De ce cortège d’espèces, seulement 19 s’avèrent
caractéristiques de ce biome, le nombre d’espèces différentes augmentant du nord vers le sud.
Cas particulier!: Leptothorax acervorum se retrouve uniquement dans la zone de la limite des
arbres. Les trois principaux genres par ordre d’importance à la fois par rapport au nombre
d’espèces et de colonies sont: Formica, Myrmica et Leptothorax. Ces résultats correspondent à
ceux obtenus pour des territoires comme le Yukon et l’Alaska (Francoeur 1998). Il s’agit d’une
faune typiquement nordique dont on discute brièvement la biogéographie.
Ces insectes habitent tous les types d’écosystèmes terrestres jusqu’à la toundra. Ils maintiennent
des populations et une diversité d’espèces plus grandes dans les milieux ouverts et semi-ouverts
que dans les milieux fermés en fonction de la couverture végétale. Les fourmis construisent
leurs nids selon les espèces dans les sols minéraux ou organiques, dans la matière ligneuse morte
ou parfois vivante. Elles peuvent aussi occuper des objets ou des matériaux artificiels produits
par l’être humain. Quelques espèces de Vertébrés les utilisent régulièrement comme aliments.
Francoeur, A. 2001. Les fourmis de la forêt boréale du Québec
(Formicidae, Hymenoptera). Le naturaliste canadien 125 (3)!: 108-114.
Numéro spécial sur la forêt boréale du Québec.
No 157

108
LA SOCIÉTÉ PROVANCHER D’HISTOIRE NATURELLE DU CANADA
LES INSECTES
André Francœur est biologiste.
Introduction
Ce premier portrait général et succinct de la myrmé-
cofaune boréale du Québec repose sur une base de près de
1 000 échantillons, accumulés depuis une trentaine d’an-
nées, ainsi que sur quelques données puisées dans la littéra-
ture. L’échantillon correspond à un prélèvement d’individus
essentiellement dans un nid ; il est effectué de façon aléatoire
lors d’inventaires généraux dans différentes régions. Dans
le cas d’inventaires quantitatifs et systématiques de milieux
ciblés, seulement deux échantillons par espèce et par biotope
ont été intégrés à cette base.
Pour répartir et analyser ces données, le territoire du
biome (tel que conçu par Richard, 1995) est partagé ainsi : la
ligne des arbres, la moitié nord incluant la toundra forestière
et la taïga, la moitié sud groupant les domaines de la pessière
et de la sapinière, le pourtour de la Sagamie (tableau 1).
Les données de ce dernier territoire, qui est inclus dans la
zone de la forêt mélangée selon la carte du ministère des Res-
sources Naturelles (Québec, 1985), permettent de mettre en
évidence des éléments de transition appartenant à la forêt
décidue. Il est évident, dans ce cas, que les bouleversements
et les transformations des milieux naturels, induits par l’in-
tervention humaine, affectent la répartition de certaines
espèces.
Espèces recensées
Le tableau 1 donne la liste des fourmis trouvées dans
différents habitats du biome. Au total, 39 espèces sont pré-
sentes, ce qui représente 41,5 % de la myrmécofaune indi-
gène du Québec (94 espèces indigènes et dix introduites –
Francœur, 2000a). Elles se répartissent en neuf genres et trois
sous-familles pour le domaine boréal en comparaison des
23 genres indigènes (plus deux introduits) et quatre sous-
familles pour tout le territoire. Phylogénétiquement la plus
primitive, la sous-famille Ponerinae, reste absente de la forêt
boréale (Francœur, 1979). À noter ici que la nomenclature
des espèces de Myrmica et de Leptothorax suit nos travaux
en cours de révision taxinomique (détails dans Francœur,
1997).
Le nombre d’espèces recensées jusqu’à présent dans
ce biome nordique représente vraisemblablement 95 % de
la diversité réelle. Toutefois, la répartition des échantillons
sur le territoire laisse apparaître un grand vide pour la partie
centrale qui est dépourvue de routes publiques. En outre,
l’effort de prospection demeure plus important dans la
moitié sud et certaines espèces sont plus faciles à dénicher
en raison de leur type de nid. Ces biais ne semblent pas
avoir faussé le portrait global qui se dégage maintenant de
notre inventaire aléatoire, car il s’accorde bien avec ce qui
est connu pour d’autres parties de ce biome circumboréal
(Collingwood, 1979 ; Dlussky, 1967 ; Francœur, 1997 ; Hea-
twole, 1989 ; Letendre et al., 1971 ; Nielsen, 1987 ; Punttila et
al., 1994b).
À la ligne des arbres, au nord du biome nous avons
recueilli des colonies de cinq espèces (tableau 1), mais
seulement des gynes désailées (femelles fondatrices) pour
Formica subnuda (Francœur, 1983). Seule Leptothorax acer-
vorum fut détectée exclusivement dans les régions adjacentes
à cette ligne, alors que les autres se rencontrent à l’échelle du
territoire boréal. La zone boréale-nord abrite dix espèces,
tandis que la zone boréale-sud en offre 26. Jusqu’à présent,
Myrmica sp. (cf. fracticornis) et Leptothorax septentrionalis
(nouveau statut taxinomique) furent trouvées seulement
dans la zone nord. On peut s’attendre à ce que le nombre
d’espèces connues pour la moitié nord augmente légèrement
avec l’exploration du centre du territoire. Dans la Sagamie,
les peuplements typiquement boréaux et de transition recè-
lent quelque 34 espèces.
Même s’il peut s’avérer partiellement biaisé, l’échan-
tillonnage global révèle l’importance naturelle relative de
ces taxons, telle que détaillée par les chiffres du tableau 2.
Celle-ci correspond à l’impression générale qui se dégage de
l’examen de nombreux biotopes. La sous-famille Formicinae
s’avère la mieux représentée avec 518 échantillons, alors que
suivent Myrmicinae (463 échantillons), puis Dolichoderinae
(14 échantillons). Cette dernière, qui se trouve essentielle-
ment dans des climats chauds, est représentée uniquement
par une espèce ubiquiste, affichant une grande valence écolo-
gique ; elle suit aisément les traces de l’espèce humaine (Fran-
cœur, 2000b ; Smith, 1965). Les deux premières sous-familles
comprennent respectivement trois et cinq genres.
Les fourmis de la forêt boréale du Québec
(Formicidae, Hymenoptera)
André Francœur

109
LE NATURALISTE CANADIEN, VOL. 125 No 3 AUTOMNE 2001
LES INSECTES
Tableau 1. Espèces de fourmis recensées dans le biome de la forêt boréale du Québec, par ordre phylogénétique des taxons
supérieurs.
Sous-famille Ligne Boréale Boréale Boréale
Espèce des
arbres nord sud Sagamie
Myrmicinae
Myrmica alaskensis Wheeler X X X X
Myrmica detritinodis Emery X X
Myrmica fracticornis Emery X X
Myrmica lampra Francœur X
Myrmica lobifrons Pergande X X
Myrmica nearctica Weber T*
Myrmica quebecensis Francœur X X
Myrmica sp. (cf. fracticornis) X
Stenamma diecki Emery T
Leptothorax acervorum (Fabricius) X X
Leptothorax sp. A X X
Leptothorax retractus Francœur X X
Leptothorax sp. (cf. canadensis Provancher) X X X X
Leptothorax sphagnicolus Francœur X
Leptothorax septentrionalis Wheeler X
Formicoxenus quebecensis Francœur X X
Harpagoxenus canadensis M. R. Smith T
Dolichoderinae
Tapinoma sessile (Say) X A X A*
Formicinae
Camponotus herculeanus (Linné) X X X X
Camponotus noveboracensis (Fitch) X A X A
Lasius alienus (Foerster) X A X A
Lasius flavus (Fabricius) T T
Lasius neoniger Emery X A X A
Lasius pallitarsis (Provancher) X A X A
Formica dakotensis Emery X X
Formica glacialis Wheeler T A T A
Formica hewitti Wheeler X X X
Formica impexa Wheeler X X
Formica Iasioides Emery T A
Formica neogagates Emery T
Formica neorufibarbis Emery X X X X
Formica podzolica Francœur X X X
Formica reflexa Buren T
Formica sp. (cf. fossaceps Buren) T
Formica spatulata Buren T
Formica subaenescens Emery X X
Formica subnuda Emery X ? X X X
Formica subsericea Say T A
Formica whymperi Forel X X
TOTAL DES ESPÈCES : 39 5 10 26 34
* T : présence dans milieux de transition ;
A : présence dans milieux modifiés par l’intervention humaine ;
? : présence continue à confirmer.

110
LA SOCIÉTÉ PROVANCHER D’HISTOIRE NATURELLE DU CANADA
LES INSECTES
Tableau 2. Répartition des échantillons (n) de fourmis selon les taxons supérieurs.
Sous-famille Genre Nombre d’espèces
Formica (408) 15
Formicinae (518) Camponotus (79) 2
Lasius (31) 4
Myrmica (236) 8
Myrmicinae (463) Leptothorax (201) 6
Formicoxenus (20) 1
Harpagoxenus (3) 1
Stenamma (3) 1
Dolichoderinae (14) Tapinoma (14) 1
Tableau 3. Répartition des échantillons par espèce pour les quatre genres typiques de la forêt boréale du Québec.
Espèce Nombre Espèce Nombre
d’échantillon d’échantillon
Formica neorufibarbis 166 Myrmica alaskensis 122
Formica podzolica 73 Myrmica detritinodis 44
Formica subnuda 62 Myrmica lobifrons 30
Formica subaenescens 26 Myrmica quebecensis 18
Formica dakotensis 17 Myrmica fracticornis 16
Formica hewitti 15 Myrmica nearctica 3
Formica subsericea 13 Myrmica sp. (cf. fracticornis) 2
Formica glacialis 9 Myrmica lampra 1
Formica Iasioides 6
Formica impexa 5 Leptothorax sp. (cf. canadensis) 125
Formica reflexa 5 Leptothorax acervorum 30
Formica whymperi 5 Leptothorax sp. A 21
Formica sp. (cf. fossaceps) 3 Leptothorax sphagnicolus 15
Formica neogagates 2 Leptothorax retractus 8
Formica spatulata 1 Leptothorax septentrionalis 2
Camponotus herculeanus 67 Camponotus noveboracensis 12
Le genre Formica apparaît, sans équivoque, le plus
important en nombre d’espèces et d’échantillons (tableau 2).
Nous avons déjà souligné que ce genre compose le tiers
(32 espèces) de la myrmécofaune du Québec entier (Fran-
cœur, 1977). Le genre Myrmica occupe le second rang, suivi
par Leptothorax. Ce sont là les genres typiques de la zone cir-
cumboréale de la région holarctique, avec le genre Campono-
tus dont l’espèce principale, C. herculeanus, s’avère probable-
ment sous-représentée. Le tableau 3 indique l’importance
relative des espèces de ces quatre
genres selon les données d’échan-
tillonnage utilisées dans cette
analyse. Les genres Formicoxenus,
Harpagoxenus et Lasius ne sont pas
considérés comme typiques du
domaine boréal.
Caractéristiques
fauniques
Il importe de qualifier cet
assemblage de 39 espèces par rap-
port au biome et à l’écologie con-
nue de ces fourmis.
On peut constater en
premier lieu que sept espèces
s’observent à l’échelle du biome
(tableau 1) : ce sont les espèces
qualifiées de générales au tableau 4. Dans les habitats où
ces insectes paraissent prospères, ils affichent en général
une grande abondance, sauf Formica hewitti (tableau 3).
Un cortège neuf espèces les accompagne régulièrement, en
particulier dans la zone boréale-sud (tableau 4). Un groupe
de sept espèces apparaît exclusif au biome, n’ayant pas été
récoltées ailleurs au Québec d’après une base actuelle de
plus de 7 500 échantillons. Enfin, cinq espèces sont consi-
dérées, pour l’instant, comme occasionnelles dans la zone

111
LE NATURALISTE CANADIEN, VOL. 125 No 3 AUTOMNE 2001
LES INSECTES
Tableau 4. Myrmécofaune caractéristique de la forêt
boréale du Québec.
Groupe Espèce
Espèces générales Camponotus herculeanus
Formica hewitti
( 7 ) Formica neorufibarbis
Formica podzolica
Formica subnuda
Leptothorax sp.
(cf. canadensis)
Myrmica alaskensis
Espèces compagnes Formica dakotensis
Formica impexa
( 9 ) Formica subaenescens
Formica whymperi
Leptothorax sp A
Leptothorax retractus
Myrmica detritinodis
Myrmica fracticornis
Myrmica lobifrons
Espèces exclusives Formicoxenus quebecencis
Leptothorax acervorum
( 7 ) Leptothorax septentrionalis
Leptothorax sphagnicolus
Myrmica sp. (cf. fracticornis)
Myrmica lampra
Myrmica quebecencis
Espèces occasionnelles Camponotus noveboracensis
Lasius alienus
( 5 ) Lasius neoniger
Lasius pallitarsis
Tapinoma sessile
sud seulement (tableau 4). L’appartenance au biome des
Lasius demeure à confirmer par de nouveaux inventaires
dans des territoires peu perturbés par intervention humaine.
Le cas de L. pallitarsis s’avère intéressant : espèce considérée
d’abord comme forestière (Francœur, 1966, Wilson, 1955),
elle s’adapte extraordinairement bien aux milieux ouverts
aménagés comme les pelouses et les jardins (Francœur,
2000b). Elle prolifère à la pointe de Penouille (parc Forillon,
Gaspé) dans un peuplement ouvert d’épinettes poussant sur
un sol sablonneux (Francœur, 1981a). Elle affiche donc une
valence écologique remarquable.
Il reste 11 autres espèces qui proviennent unique-
ment de milieux de transition (T) ou modifiés par l’humain
(A). Ces fourmis appartiennent au biome de la forêt déci-
due et, en conséquence, ne sont pas incluses dans la faune
boréale.
Au total, on peut conclure que la myrmécofaune
caractéristique de la forêt boréale du Québec se compose de
28 espèces seulement (tableau 4). Une pauvreté typiquement
nordique, de climat froid, par rapport aux zones plus méri-
dionales. Phénomène général bien connu, l’axe sud-nord de
réduction du nombre d’espèces apparaît aussi nettement
pour cette faune particulière.
Les habitats
Les fourmis occupent tous les milieux terrestres,
plus ou moins intensivement, à l’exception de la toundra
(Francœur, 1983 ; Hölldobler et Wilson, 1990). En zone
boréale, elles préfèrent les habitats partiellement ou totale-
ment ouverts. Elles sont peu présentes en forêt très fermée,
car la quantité d’énergie radiante disponible au niveau du sol
représente un facteur limitant déterminant (Brown, 1973 ;
Punttila et al., 1994b). On rencontre principalement Cam-
ponotus herculeanus et Myrmica alaskensis dans les forêts
fermées. Les bordures de lacs et de rivières sont mieux peu-
plées.
Les espèces des quatre genres dominants préfèrent
globalement les milieux avec litière sur sol minéral et une
végétation à dominance arborescente. Les arbustaies denses
sont peu fréquentées, de même que les palses (tertres com-
posés d’une couche de tourbe ayant un noyau pergélisolé
sur sol minéral). Certaines, comme Formica neorufibarbis
(surtout la forme toundra – Francœur, 1973) et Leptothorax
acervorum (Francœur, 1983), peuvent prospérer dans des
milieux partiellement dénudés, sur sable ou rocaille.
La pessière à cladonie du sud, particulièrement dans
le parc des Grands-Jardins et sur la Côte-Nord, abrite plu-
sieurs espèces dont des formes parasites très singulières telles
que Formicoxenus quebecencis, Myrmica lampra et M. quebe-
cencis (Béique et Francœur, 1966 et 1968 ; Francœur, 1968 et
1981b ; Francœur et al., 1985). Les tourbières ombrotrophes
de la Sagamie, dans les phases d’afforestation (établissement
des arbres) de leur succession écologique, se distinguent par
la présence de Formica dakotensis, Leptothorax sphagnicolus
et Myrmica lobifrons; elles disparaissent du biotope au stade
climacique (données inédites; Francœur, 1986 ; Francœur et
Pépin, 1975 et 1978). Les pinèdes à pin gris abritent la plu-
part des espèces rares et quelques espèces dites de transition
de la zone sud et de la Sagamie (Francœur et Jobin, 1968),
alors que les pinèdes à pin rouge recèlent plusieurs espèces
de transition comme Myrmica nearctica et Stenamma diecki
(une espèce caractéristique de l’érablière laurentienne avec
Lasius pallitarsis, Francœur, 1966).
 6
6
 7
7
 8
8
1
/
8
100%