Découverte de la réaction chimique

1
Formation CECAFOC – Brajkovic D. et Wagelmans B. mars 2013
Utiliser le TBI et la modélisation en complément de la démarche expérimentale
Découverte de la réaction
Découverte de la réactionDécouverte de la réaction
Découverte de la réaction
chimique
chimiquechimique
chimique
1.
1.1.
1. Mise en situation
Mise en situation Mise en situation
Mise en situation
Un
UnUn
Une
ee
e
magicien
magicienmagicien
magicienne prétend qu’elle
ne prétend qu’ellene prétend qu’elle
ne prétend qu’elle
fait disparaître du
fait disparaître du fait disparaître du
fait disparaître du
M
MM
Ma
aa
ag
gg
gnésium
nésiumnésium
nésium
!
!!
!
Magique ou chimique
Magique ou chimiqueMagique ou chimique
Magique ou chimique
?
? ?
?
Qu’en
Qu’en Qu’en
Qu’en pensez
pensezpensez
pensez-
--
-vous
vousvous
vous
?
??
?

2
Formation CECAFOC – Brajkovic D. et Wagelmans B. mars 2013
Utiliser le TBI et la modélisation en complément de la démarche expérimentale
2.
2.2.
2. Comment définir une réaction chimique
Comment définir une réaction chimiqueComment définir une réaction chimique
Comment définir une réaction chimique
?
??
?
Mission 1
Mission 1Mission 1
Mission 1
:
::
: Essayons de reproduire le « tour de magie » !
A partir du matériel et des produits présents sur cette photo, il est possible
de reproduire le « tour de magie ».
Consignes:
Travailler par groupes de 2.
Proposer différentes expériences que vous réaliserez après accord de votre
professeur.
Expérimenter en utilisant des petits bouts de ruban de magnésium (1cm)
Travailler en respectant les consignes de sécurité (cfr. pictogrammes)
Observer ce qui se passe pour chaque essai
En déduire le « truc » de la magicienne
Rédiger, à l’aide de schémas, un rapport structuré de votre manipulation :
conditions expérimentales, résultats positifs, négatifs, conclusions.

3
Formation CECAFOC – Brajkovic D. et Wagelmans B. mars 2013
Utiliser le TBI et la modélisation en complément de la démarche expérimentale
Mission 2
Mission 2Mission 2
Mission 2
:
: :
:
Essayons de comprendre le « tour de magie » !
a) Formulez des hypothèses :
1) A l’aide des modèles moléculaires, modélisez les espèces de départ :
prenez des atomes de Mg et construisez des molécules de chlorure
d’hydrogène (ou acide chlorhydrique)(cfr. fiche outil si nécessaire).
Emettez une ou des hypothèses concernant les espèces chimiques obtenues
après réaction.
b) Expérimentez – vérifiez vos hypothèses.
Proposez par écrit une série de tests pour confirmer vos hypothèses
concernant les substances obtenues. Aidez-vous du guichet de
renseignements
Consignes :
Travailler par groupes de 2.
Avant de manipuler, présenter un projet écrit à votre professeur.
Manipuler en respectant les consignes de sécurité.
Utiliser des petits bouts de ruban de magnésium (1cm). Votre groupe
dispose au maximum de 3cm de ruban de Mg.

4
Formation CECAFOC – Brajkovic D. et Wagelmans B. mars 2013
Utiliser le TBI et la modélisation en complément de la démarche expérimentale
Guichet de renseignements :
Comment identifier un gaz
Comment identifier un gazComment identifier un gaz
Comment identifier un gaz
?
??
?
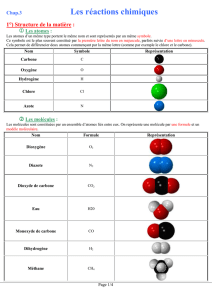
1. Le dioxygène O
2
:
Le O
2
ravive une flamme.
2 . Le dihydrogène H
2
:
Le H
2
« aboie » à la flamme.
- approcher une allumette enflammée
au bord du tube à essai
3. Le gaz carbonique CO
2
:
Le CO
2
trouble l’eau de chaux
- à l’aide d’un tube coudé, faire barboter
le gaz dans l’eau de chaux
4. Le gaz H
2
S 5. Le gaz NH
3
6. Le gaz Cl
2
Odeur d’œuf
pourri
Odeur
d’ammoniac
Odeur de
« chlore »

5
Formation CECAFOC – Brajkovic D. et Wagelmans B. mars 2013
Utiliser le TBI et la modélisation en complément de la démarche expérimentale
Comment déterminer si une solution
Comment déterminer si une solution Comment déterminer si une solution
Comment déterminer si une solution
contient des ions
contient des ionscontient des ions
contient des ions
?
??
?
Réactif utilisé
Réactif utiliséRéactif utilisé
Réactif utilisé
Résultat du test
Résultat du testRésultat du test
Résultat du test
Cl
-
Solution de nitrate d’argent (I)
AgNO
AgNOAgNO
AgNO
3
33
3
Précipité blanc qui noircit
à la lumière
Mg
2+
Solution d’hydroxyde de sodium
NaOH
NaOHNaOH
NaOH
Précipité blanc floconneux
Ca
2+
Solution d’oxalate d’ammonium
(NH
(NH(NH
(NH
4
44
4
)
))
)
2
22
2
C
CC
C
2
22
2
O
OO
O
4
44
4
Précipité blanc
PO
4 3-
Solution de nitrate d’argent
AgNO
AgNOAgNO
AgNO
3
33
3
Précipité jaunâtre
SO
42-
Solution chlorure de baryum
BaCl
BaClBaCl
BaCl
2
22
2
Précipité blanc
Cu
2+
Solution d’hydroxyde de sodium
NaOH
NaOHNaOH
NaOH
Précipité bleu
Fe
2+
Solution d’hydroxyde de sodium
NaOH
NaOHNaOH
NaOH
Précipité vert
Fe
3+
Solution d’hydroxyde de sodium
NaOH
NaOHNaOH
NaOH
Précipité rouille
Zn
2+
Solution d’hydroxyde de sodium
NaOH
NaOHNaOH
NaOH
Précipité blanc
Tableau récapitulatif de quelques tests chimiques
Tableau récapitulatif de quelques tests chimiquesTableau récapitulatif de quelques tests chimiques
Tableau récapitulatif de quelques tests chimiques
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%