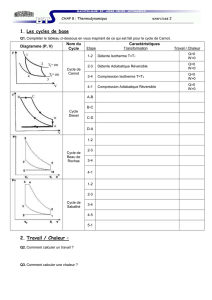
Problme I

Problèmes types d’examen
Problème I
Un cycle de Carnot utilisant 1 Kg d'air (supposé gaz parfait) comme fluide de
fonctionnement possède un rendement de 40
0
0
. Au début de la détente isotherme la
pression est 6,2 atm et le volume de l'air est 0,1 m3. Si la quantité de chaleur fournie
au cycle est de 50 KJ, déterminer:
a) Le nombre de moles sachant que dans les conditions normales le volume
molaire gazeux est 22,4 l et la masse du litre d'air est 1,3 g .
b) La plus haute et la plus basse température atteintes par le gaz durant le cycle.
c) Le travail et la quantité de chaleur échangés pendant chaque transformation.
On donne R= 8,32 uSI
Problème II
2 Kg d'eau à 90 0C sont mélangés avec 5Kg de glace à 0 0C dans un système isolé.
Calculer:
a) La composition et la température du mélange à l'équilibre.
b) La variation de l'entropie du système eau – glace.
c) Si on avait 1 Kg de glace au lieu de 5Kg calculer:
La composition et la température du mélange à l'équilibre.
La variation de l'entropie du système eau – glace.
La chaleur spécifique de l'eau est de 4.18
KKgKJ .
, et la chaleur latente de fusion de
la glace est L = 333.5
KgKJ
.
Problème III
Déterminer le rendement du cycle de Diesel sachant que dans un diagramme de
Clapeyron ce cycle se compose de 2 isentropiques (BC et DA), d'une transformation
isobare AB réversible et d'une transformation isochore CD réversible.
Exprimer le rendement de ce cycle décrit en sens direct en fonction du rapport de
compression a =
AD VV
et du rapport de détente b =
BC VV
.
On supposera qu'on utilise un gaz parfait de capacités thermiques massiques
constantes.

Problème IV
Montre que:
VTCCTP V
P
v
Problème V
On dispose de 2 sources de chaleur nécessaires pour réaliser réversiblement un
cycle
ADCBA
composé de 2 isothermes (AB et CD) et de 2 isochores
(BC et DA).
On notera T1 la température en A et B et T2 la température e C et D.
Le système est constitué par 1.10-3 Kg d'un gaz assimilable à un gaz parfait dont la
masse molaire M = 29.10-3 Kg et dont
C
C
= 1.4
On donne :
VA= 0,8.10-4m3, PA= 40 atm, PC = 1 atm : T2 = 300K et R = 8,32 J. (mole.K)-1.
1) Déterminer les valeurs de P, V, T aux points A, B, C et D du cycle.
2) Calculer la variation de l'énergie interne, le travail, la quantité de chaleur et
l'enthalpie échangés pendant chaque transformation du cycle.
3) Vérifier que
0 cycle
U
.
Problème VI
1) Montrer que :
T
XP
Avec:
le coefficient de dilatation à pression constante,
le coefficient
d'augmentation de la pression à volume constant,
T
X
la compressibilité isotherme.
2) Montrer que:
Pour un gaz parfait qui subit une transformation adiabatique la pression P et le volume
V varient selon la loi
PV
= constante où
C
C
(retrouver cette loi).

Problème VII
Un gaz obéit à l'équation de Van der Waals qui s'écrit pour une mole:
RTbV
V
a
P
2
a et b: constantes positives
1) Dans le système international, quelles sont les unités de a et b?
2) Ecrire l'équation de Van der Waals dans le cas de n moles.
Problème VIIi
On dispose des sources de chaleur nécessaires pour réaliser réversiblement un cycle
ADCBA
composé de deux isothermes (AB et CD) et de deux isochores
(BC et DA).
On notera T1 la température en A et B et T2 la température en C et D.
P
V
A
B
C
D
1
T
2
T
En fonction des paramètres d'état variables: VA, T1, T2, PC, établir les expressions:
a) de la quantité de chaleur Q1 reçue par le système au cours d'un cycle moteur
réversible;
b) de la quantité de chaleur Q2 cédée par le système au cours d'un cycle moteur
réversible;
c) du rendement thermodynamique de cycle
1
Q
W
.
1) Quelle est l'expression du rendement thermodynamique du cycle de Carnot
réversible correspondant (c'est–à–dire utilisant des sources dont les
températures sont égales aux températures extrêmes précédentes)?
2) Comparer les deux rendements et montrer que le sens de l'inégalité est
indépendant des valeurs numériques des paramètres.
3) Calculer les valeurs numériques des expressions établies en 10, 20, dans le cas
où VA= 0,80.10-4 m3, PA= 40 atm, PC = 1,0 atm, T2 = 300K.
Note: On prendra R = 8,32 j. (mole. K)-1, 1 atm = 105 Pa, n =
29
1
,
4,1
.

Problème IX
Sous une pression de 1bar, la température d'équilibre entre les 2 variétés
etSS
du
soufre est
KT 7,368
0
.
Elle s'élève de 3,94.10-2 K par bar. La chaleur latente de transformation de la forme
S
en la forme
S
est L= 3,12 cal.g-1.
Calculer la variation du volume massique (
) accompagnant la transformation.
On rappelle
dT
dP
TL
1bar = 105 pa
1cal = 4,18 j
Problème X
Une enceinte adiabatique est constituée de deux volumes V1 identiques séparés par
une paroi mobile, elle-même adiabatique.
Chaque enceinte contient un gaz parfait diatomique dans l'état P1, V1, T1 et l'enceinte
de gauche contient une résistance R1, de volume et de capacité calorifique
négligeables, alimentée par un générateur de force électromotrice E. On suppose que
les échanges thermiques entre la résistance et le gaz sont rapides et que le mouvement
du piston est lent.
A t = 0, on abaisse l'interrupteur K et on le relève lorsque la pression dans l'enceinte
de gauche atteint 2P1. Pour les applications numériques, on prendra:
P1= 0,5bar V1= 5 L T1= 300 K E = 3 V R1=
5
.
1) Préciser la nature des transformations que subissent les gaz de chaque
enceinte.
2) Calculer les valeurs des paramètres P2, V2, T2 de l'état final du gaz
dans la partie droite de l'enceinte.
3) En déduire la température finale T1 dans l'enceinte de gauche.
4) Calculer le temps t de l'expérience.
Problème XI
On considère n moles d'un gaz parfait suivant le cycle de Carnot. Ce cycle est
moteur, réversible, et est constitué de deux transformations isothermes aux
températures T1 et T2 et de deux adiabatiques. On note V1, V2, V3, V4 les quatre
volumes successifs.

1) Donner pour chaque transformation i les expressions de Qi, Wi, et
i
U
en
fonction des Vi et de n, T1 et T2. On présentera les résultats dans un tableau.
2) Montrer que
4
3
1
2
V
V
V
V
.
3) On définit le rendement d'un cycle moteur par le rapport entre le travail récupéré
par l'extérieur et l'énergie calorifique fournie au fluide:
fournie
Q
W
r
.
Calculer le rendement r du cycle de carnot.
Problème XII
On dispose des sources de chaleur nécessaires pour réaliser réversiblement un
cycle
ADCBA
composé de 2 isothermes AB et CD et de 2 isochores
BC et DA suivant le schéma ci-dessous:
 6
6
 7
7
1
/
7
100%