Contrôle du développement du noyau spinal d`Onuf

LEPOINT SUR... Progrès en Urologie (2002), 12, 340-343
340
Contrôle du développement du noyau spinal d’Onuf
Martin CATALA
Laboratoire d’Histologie et Embryologie/UMR CNRS 7000, Université Paris 6, France
Avec l’apparition d’une reproduction sexuée, le com-
portement des deux sexes s’est spécialisé. Dans cer-
taines espèces, seul un des deux sexes présente un com-
portement particulier. Par exemple, chez certains
amphibiens, seuls les mâles peuvent produire un chant
impliqué dans les comportements sexuels ultérieurs. Le
substratum morphologique d’une telle spécialisation
est l’objet d’une recherche active en Neurosciences. En
effet, il a été mis en évidence des différences morpho-
logiques entre les deux sexes au niveau de certains
noyaux cérébraux. Cette différence est dénommée
dimorphisme sexuel. Ainsi, chez le xénope (une espè-
ce d’amphibien anoure du sud de l’Afrique), il existe
une différence dans le nombre de cellules exprimant le
récepteur des androgènes au niveau du noyau du IX-X
qui pourrait rendre compte de certains comportements
sexuels [17].
Une des régions présentant un dimorphisme sexuel évi-
dent chez les mammifères est la région périnéale. Les
muscles de cette région présentent une morphologie
très différente chez la femelle et le mâle. Chez le mâle,
les muscles bulbo-caverneux, ischio-caverneux, rele-
veur de l’anus et les sphincters externes de l'anus et de
l'urètre sont innervés par des motoneurones dont le
corps cellulaire est situé dans la corne ventrale de la
moelle épinière sacrée. Certains de ces muscles s’insè-
rent au niveau du pénis et jouent un rôle au cours de
l’érection et l’éjaculation dans l’espèce humaine et
pour les réflexes péniens chez les chiens et les rats. Les
motoneurones contrôlant ces muscles forment le noyau
spinal d’Onuf. On distingue anatomiquement deux
régions au sein de ce noyau : la portion dorsomédiane
contient les motoneurones des sphincters, la portion
ventrolatérale les motoneurones des muscles bulbo- et
ischio-caverneux. Le noyau d’Onuf existe tant chez la
femelle que chez le mâle toutefois la partie ventro-laté-
rale de ce noyau est beaucoup plus volumineuse chez le
mâle que chez la femelle [3, 7]. Pour illustrer ce fait, il
suffit à nos lecteurs de noter que chez le rat mâle adul-
te, ce noyau est constitué d’environ 200 motoneurones
[3] alors qu’il n’en contient que 60 chez la femelle
[14]. Chez la femelle, ces motoneurones innervent le
sphincter externe de l’anus, les autres muscles pelviens
étant atrophiques chez la femelle. L’apparition de la
mise en place de ce dimorphisme sexuel varie selon les
espèces. Elle se fait avant la naissance chez le chien, en
période périnatale chez le rat et est retardée chez la ger-
boise [11].
Des données récentes provenant d’expérimentations
animales ont permis de mieux comprendre la constitu-
tion d’un tel dimorphisme entre les deux sexes. La cas-
tration de jeunes rats mâles dans la période qui suit
immédiatement la naissance conduit à une régression
du noyau d’Onuf qui prend alors un aspect morpholo-
gique similaire à celui des femelles [4]. Cette régres-
Manuscrit reçu : avril 2002, accepté : avril 2002
Adresse pour correspondance : Dr.M. Catala, Laboratoire d’Histologie et
Embryologie/UMR CNRS 7000, Faculté de Médecine Pitié-Salpêtrière,
Université Paris 6, 105, Bd. de l’Hôpital, 75634 Paris Cedex 13
E-mail : [email protected]
Ref : CATALA M., Prog.Urol., 2002, 12, 2, 340-343.
RESUME
Le noyau d’Onuf est situé au niveau de la moelle épinière sacrée et contient les moto-
neurones qui innervent les muscles périnéaux. Le nombre de neurones et leur taille
est très variable entre le mâle et la femelle réalisant un dimorphisme sexuel. La mise
en place de ce dimorphisme nécessite une imprégnation androgénique. En absence de
ces facteurs, les motoneurones meurent par apoptose. Cet effet androgénique n’est
pas direct sur les motoneurones mais ces hormones agissent sur les muscles périnéaux
assurant leur survie. Les muscles périnéaux produisent à leur tour des facteurs tro-
phiques qui agissent de façon rétrograde sur les motoneurones. Un de ces facteurs de
survie pourrait être le CNTF (Ciliary Neurotrophic Factor). Plus tard au cours du
développement, les androgènes agissent directement sur les motoneurones soit sur
leur propre récepteur soit après conversion intracellulaire en œstrogènes par l’aro-
matase.
Mots clés : muscles périnéaux, noyau d’Onuf, dimorphisme sexuel, androgènes.

341
sion est annulée si on traite ces jeunes mâles après la
castration par des androgènes [4, 5]. Toutefois il faut
noter que cet effet des androgènes ne se voit que si le
traitement est mis en place avant le 11e jour post-natal
[5]. Ceci suggère qu’il existe donc une période de sus-
ceptibilité au-delà de laquelle les neurones ne sont plus
sensibles aux androgènes. L’exposition in utero de rats
mâles au flutamide (traitement qui a un effet anti-
androgénique) entraîne une diminution du nombre de
neurones dans leur noyau d’Onuf [12]. On peut induire
une masculinisation du noyau d’Onuf de chiennes si
elles sont exposées pendant la période de la vie intra-
utérine aux androgènes [7]. Il faut noter que cette trans-
formation est définitive même si le traitement n’est
appliqué que pendant la période prénatale.
On peut donc conclure que les androgènes jouent un
rôle majeur dans l’établissement du dimorphisme du
noyau spinal d’Onuf. En absence d’androgènes, le
noyau d’Onuf régresse par mort programmée chez la
femelle dans les trois premières semaines post-natales
chez le rat [15]. On peut empêcher cette mort par admi-
nistration d’androgènes pendant la période périnatale
[15]. En cas d’imprégnation androgénique, les moto-
neurones survivent engendrant une noyau d’Onuf volu-
mineux.
Quel est le mécanisme d’action cellulaire des andro-
gènes? Les motoneurones du noyau d’Onuf accumu-
lent la testostérone et la dihydrotestostérone circulantes
[3]. Un tel dimorphisme sexuel n’apparaît pas en cas de
mutation inactivatrice du récepteur des androgènes [3].
Tout ceci suggère que les motoneurones du noyau
d’Onuf sont sensibles aux androgènes via leur action
sur le récepteur de ces hormones. Ces données invitent
à proposer que les androgènes exercent une action
directe sur les motoneurones du noyau d’Onuf.
Toutefois rien n’indique une action directe entre les
androgènes et les motoneurones. Ces effets pourraient
être dus à un relais cellulaire exerçant des effets à long
terme. Aussi les androgènes pourraient avoir une
action directe sur les motoneurones ou sur des cellules
qui à leur tour exerceraient des effets trophiques sur les
motoneurones.
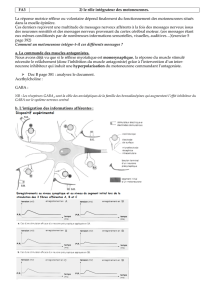
Pour discriminer entre ces deux hypothèses, KURZ a
extirpé chirurgicalement, chez le rat, les muscles cibles
des motoneurones du noyau d’Onuf précocement avant
l’établissement du dimorphisme sexuel. Dans ces
conditions, la survie des motoneurones ne dépend plus
de l’imprégnation androgénique. Ainsi, on peut donc
conclure que (1) le dimorphisme sexuel dépend de la
présence des muscles cibles, (2) l’effet des androgènes
s’exerce sur les muscles cibles plutôt que sur les moto-
neurones et (3) les muscles cibles émettent un signal de
survie véhiculé par les motoneurones vers leur corps
cellulaire via le transport rétrograde (Figure 1).
Tous ces résultats suggèrent donc l’existence d’un
signal trophique issu des cellules musculaires striées
squelettiques et agissant sur les motoneurones spinaux.
Le Ciliary Neurotrophic Factor (CNTF) est une molé-
cule sécrétée qui a une action neurotrophique sur l'en-
semble des motoneurones [16]. On peut donc le propo-
ser comme candidat moléculaire rendant compte de
Martin Catala, Progrès en Urologie (2002), 12, 340-343
Figure 1. Les androgènes agissent en favorisant la survie des
muscles périnéaux qui produisent des facteurs trophiques qui
assurent le maintien des motoneurones du noyau d’Onuf.
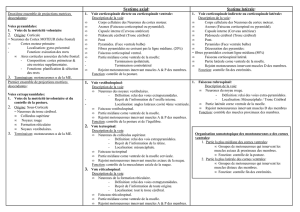
Figure 2. Les deux voies d’action des androgènes : soit ils
pénètrent dans le noyau et agissent sur leur récepteur, soit ils
sont transformés en oestrogènes par l’aromatase. Ces derniers
agissent dans le noyau sur leur récepteur.
Androgènes
Androgènes
Androgènes
Oestrogènes
Cytoplasme
Milieu
extra-cellulaire
Aromatase
Oestrogènes
Noyau
Récepteur
des androgènes
Récepteur
des œstrogènes

cette action de survie sur les neurones du noyau
d’Onuf. Pour établir une telle propriété, on a adminis-
tré du CNTF pendant la période périnatale chez le rat
femelle. Cette administration prévient la mort des
motoneurones des noyaux d’Onuf [9], et ceci est obser-
vé même dans la souche de rat qui présente une muta-
tion inactivatrice du récepteur des androgènes montrant
bien que le CNTF n’agit pas par cette voie [10]. Il exis-
te une souche de souris pour laquelle le gène codant le
récepteur membranaire du CNTF a été invalidé. Dans
ce cas, le dimorphisme sexuel spinal ne s’établit pas
malgré la sécrétion d’androgènes chez le mâle [8].
Toutes ces données montrent donc que le CNTF agit en
aval de la voie des androgènes dans le contrôle de l’éta-
blissement du dimorphisme sexuel. Toutefois, il faut
bien se garder de penser que le système impliqué dans
ces effets est si simple. En effet, le CNTF n’agit que de
façon transitoire alors que les androgènes induisent un
dimorphisme définitif [1]. On peut donc en inférer que
les androgènes jouent un rôle via plusieurs systèmes de
substances neurotrophiques dont le CNTF. Ainsi ce
dernier pourrait avoir un rôle initiateur de ce processus
mais il serait nécessaire que son action soit maintenue
par d’autres molécules.
Ainsi, les androgènes n’ont pas une action directe sur
les motoneurones spinaux du noyau d’Onuf. Toutefois,
un tel rôle peut-il être définitivement écarté? La taille
du corps cellulaire des motoneurones innervant le
muscle bulbocaverneux est plus importante chez le
mâle que chez la femelle [2] et cet effet dépend direc-
tement d’une action des androgènes sur un récepteur
fonctionnel des androgènes [18]. Si on observe le déve-
loppement des dendrites des motoneurones du noyau
d’Onuf chez le rat, on s’aperçoit qu’elles grandissent
considérablement à partir du 28ème jour post-natal.
Cette croissance est inhibée par la castration précoce, et
elle est restaurée par l’administration de testostérone ou
de dihydrotestostérone associée à des œstrogènes.
Ainsi, on peut donc conclure que cette croissance den-
dritique dépend des androgènes (directement ou non).
Les androgènes sont capables de pénétrer à l’intérieur
des motoneurones où ils peuvent agir sur le récepteur
nucléaire des androgènes ou être métabolisés par l’aro-
matase en œstrogènes qui agissent sur leur récepteur
nucléaire (Figure 2). Il est possible de bloquer spécifi-
quement l’aromatase par le fadrozole. Dans ce cas, si
un tel blocage est effectué pendant la période périnata-
le chez le rat mâle, les dendrites des motoneurones du
noyau d’Onuf ne se développent pas [6]. Ceci montre
donc que l’action des androgènes sur les dendrites des
motoneurones du noyau dOnuf passe par une aromati-
sation et une action des œstrogènes sur leur récepteur.
Chez le rat pendant la période périnatale, les ovaires
des femelles ne produisent pas de grandes quantités d’
œstrogènes et n’agissent donc pas sur les motoneurones
spinaux.
Dans l’espèce humaine, rien n’est connu quant à la date
d’apparition de ce dimorphisme sexuel. Toutefois, il est
classique de constater que le système nerveux humain
à la naissance est beaucoup plus mature que celui des
rongeurs. Dans cette optique, on peut postuler que
l’établissement du dimorphisme se réalise pendant la
vie intra-utérine. Nos lecteurs se rendent compte que
pour affirmer une telle hypothèse, il suffit d’analyser
des moelles épinières fœtales humaines pour dater l’ap-
parition d’un tel dimorphisme. Une telle étude n’a pas
qu’un intérêt anecdotique. En effet, si le dimorphisme
spinal se développe pendant la vie fœtale, il existe alors
une imprégnation œstrogénique des fœtus masculins et
féminins du fait du passage des hormones de la circu-
lation maternelle vers celle du fœtus. Aussi, si les hor-
mones féminines pénètrent dans les motoneurones,
elles peuvent agir et masculiniser les dendrites de ces
neurones. Une telle action est empêchée par la liaison
des hormones stéroïdes maternelles à l’alpha-fœto-pro-
téine. Un tel complexe ne peut, en effet, pénétrer dans
la cellule. Ainsi, les hormones maternelles dans l’espè-
ce humaine ne peuvent avoir d’action intra-cellulaire
chez le fœtus, ce qui prévient la masculinisation des
centres nerveux des fœtus féminins.
Ainsi, le dimorphisme sexuel du noyau d’Onuf est lié à
une imprégnation androgénique qui permet la survie des
muscles périnéaux. Ces muscles en retour émettent un
signal trophique qui permet le maintien des motoneurones
spinaux du noyau d’Onuf chez le mâle alors qu’ils dégé-
nèrent chez la femelle. Ce signal trophique n’est pas entiè-
rement connu et pourrait correspondre à plusieurs facteurs
moléculaires dont le CNTF. Après le maintien des moto-
neurones spinaux, les androgènes agissent directement
sur ces cellules pour favoriser la pousse dendritique. Cet
e ffet s’explique par la transformation intracellulaire des
androgènes en œstrogènes sous l’action de l’aromatase.
REFERENCES
1. BENGSTON L., LOPEZ V., WATAMURA S., FORGER N.G. -
Short- and long-term effects of ciliary neurotrophic factor on andro-
gen-sensitive motoneurons in the lumbar spinal cord. J. Neurobiol.,
1996, 31, 263-273.
2. BREEDLOVE S.M. – Neonatal androgen and estrogen treatments
masculinize the size of motoneurons in the rat spinal nucleus of the
bulbocavernosus. Cell. Mol. Neurobiol., 1997, 17, 687-697.
3. BREEDLOVE S.M., ARNOLD A.P. - Hormone accummulation in a
sexually dimorphic motor nucleus of the rat spinal cord. Science,
1980, 210, 564-566.
4. BREEDLOVE S.M., ARNOLD A.P. - Hormonal control of a develo-
ping neuromuscular system. I. Complete demasculinization of the
male rat spinal nucleus of the bulbocavernosus using the anti-andro-
gen flutamide. J. Neurosci., 1983a, 3, 417- 423.
5. BREEDLOVE S.M., ARNOLD A.P. - Hormonal control of a deve-
loping neuromuscular system. II. Sensitive periods for the androgen-
induced masculinization of the rat spinal nucleus of the bulbocaver-
nosus. J. Neurosci., 1983b, 3, 424-432.
342
Martin Catala, Progrès en Urologie (2002), 12, 340-343

____________________
6. BURKE K.A., KUWAJIMA M., SENGELAUB D.R. - Aromatase
inhibition reduces dendritic growth in a sexually dimorphic rat spi-
nal nucleus. J. Neurobiol., 1999, 38, 301-312.
7. FORGER N.G., BREEDLOVE S.M. - Sexual dimorphism in human
and canine spinal cord: role of early androgen. Proc. Natl. Acad. Sci.
USA, 1986, 83, 7527-7531.
8. FORGER N.G., HOWELL M.L., BENGSTON L., MAC KENZIE L.,
DE CHIARA T.M., YANCOPOULOS G.D. - Sexual dimorphism in
the spinal cord is absent in mice lacking the ciliary neurotrophic fac-
tor receptor. J. Neurosci., 1997, 17, 9605-9612.
9. FORGER N.G., ROBERTS S.L., WONG V., BREEDLOVE S.M. -
Ciliary neurotrophic factor maintains motoneurons and their target
muscles in developing rats. J. Neurosci., 1993, 13, 4720-4726.
10. FORGER N.G., WONG V. BREEDLOVE S.M. - Ciliary neurotro-
phic factor arrests muscle and motoneuron degeneration in andro-
gen-insensitive rats. J. Neurosci., 1995, 28, 354-362.
11. FRALEY G.S., ULIBARRI C. – Sexual dimorphism in the number
and size of SNB motoneurons : delayed development during normal
ontogeny. Dev. Brain Res., 2001, 126, 57-64.
12. GRISHAM W., CASTO J.M., KASHON M.L., WARD I.L., WARD
O.B. – Prenatal flutamide alters sexually dimorphic nuclei in the spi-
nal cord of male rats. Brain Res., 1992, 578, 69-74.
13. KURZ E.M., COVER A.R., SENGELAUB D.R. - Testosterone fails
to save androgen-sensitive rat motoneurons following early target
removal. Dev. Brain Res., 1992, 70, 181-189.
14. MAC KENNA K.E., NADELHALFT I. - Organization of the puden-
dal nerve in the male and female rat. J. Comp. Neurol., 1986, 248,
532-549.
15. NORDEEN E.J., NORDEEN K.W., SENGELAUB D.R., ARNOLD
A.P. - Androgens prevent normally occuring cell death in a sexually
dimporhic spinal nucleus. Science, 1985, 229, 671-673.
16. OPPENHEIM R., PREVETTE D., QIN-WEI Y., COLLINS F., MAC
DONALD J. - Control of embryonic motoneuron survival in vivo by
ciliary neurotrophic factor. Science, 1991, 251, 1616-1618.
17. PEREZ J., COHEN M.A., KELLEY D.B. – Androgen receptor
mRNA expression in Xenopus laevis CNS : sexual dimorphism and
regulation in laryngeal motor nucleus. J. Neurobiol., 1996, 30, 556-
568.
18. WATSON N.V., FREEMAN L.M., BREEDLOVE S.M. – Neuronal
size in the spinal nucleus of the bulbocavernosus: direct modulation
by androgen in rats with mosaic insensitivity. J. Neurosci., 2001, 21
, 1062-1066.
____________________
SUMMARY
Control of the development of Onuf’s spinal nucleus.
Onuf’s nucleus is located at the sacral level of the spinal cord
and is formed by the motoneurons innervating the perineal
muscles. Both the number and the size of these neurons vary bet -
ween males and females creating a so-called sexual dimor -
phism. This dimosphism is mediated by androgens. In absence
of these hormones, the motoneurons die by apoptosis. This
androgenic effect is not mediated directly on the motoneurons
but on perineal muscles. These muscles survive by the action of
androgens and they secrete factors that act to promote moto -
neuronal survival. One of these factors could be CNTF (Ciliary
Neurotrophic Factor). Later during development, androgens act
directly on motoneurons either by binding their own receptor or
by intracellular transformation into estrogens due to the action
of the aromatase.
Key Words : Perineal muscles, Onuf’s nucleus, sexual dimor -
phism, androgens.
343
Martin Catala, Progrès en Urologie (2002), 12, 340-343
1
/
4
100%