Lire la suite

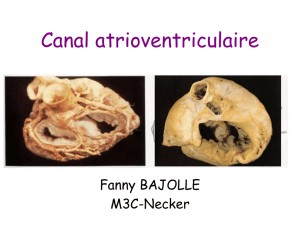
Canal atrioventriculaire
guillaumont.s@institut-st-pierre.fr
s-guillaumont@chu-montpellier.fr
DIU 2015
INSTITUT-ST-PIERRE
ESPIC
Palavas/Flots

DEFINITIONS CAV
DEFINITION ANATOMIQUE
zone de jonction entre oreillettes et ventricules à 3
composants
DEFINITION EMBRYOLOGIQUE
organisation autour de la zone mésenchymateuse des
bourgeons de la septation
DEFINITION PATHOLOGIQUE
association d’une valve AV commune (un seul anneau)
d’une CIA type ostium primum, d‘une CIV d’admission
Difficultés et précision
diagnostique Variétés et incertitude
hémodynamique Enjeu et défi
chirurgical

Embryologie: rappel septation normale
3 séquences
Formation des valves auriculoventriculaires:
- au stade de la boucle
- extension de la connexion AV droite dans l’entonnoir
tricuspidien
- formation de la valve tricuspide et de la valve mitrale à partir
des bourgeons endocardiques (processus de délamination sauf
pour le feuillet antérieur de la mitrale)
Houyel L Séminaire de Necker
2013

Embryologie: rappel septation normale
3 séquences
Formation du septum vestibulaire
- Septum primum: croissance vers le bas
- Épine vestibulaire: croissance en avant
-Bourgeons : fusion et fermeture de l’ostium
primum
-Muscularisation secondaire de cette zone
mésenchymateuse
Formation de septum d’admission
-Bourgeons: fusion et expansion
- Muscularisation secondaire
Schleich et al. Arch cardiovasc dis 2013

Morphogénèse du CAV:
évolution du concept
Anomalie de formation de la jonction AV par défaut de
septation auriculoventriculaire auquel participe la valve AV
commune
Endocardial cushion defects atrioventricular defects
- défaut mésenchymateux
- défaut myocardique
- défaut d’alignement des septa
TC
1er champ
cardiaque
2ième
Champ
cardiaque
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
1
/
62
100%