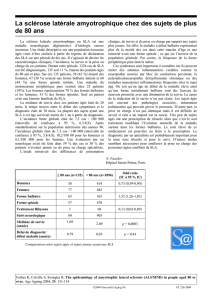
Diagnostic

la SLA
V DANEL BRUNAUD
veronique.danel@chru-lille.fr

En Europe
Pic 50-70 ans, Homme (sex ratio 1.5/1)
Incidence (Logroscino et al, 2011)
Globale = 2.16 pour 100 000 et par an, homogène
selon les pays d’Europe
I=3 chez les hommes où F spinales
I=2,4 chez les femmes où F Bulbaires
I après 50 ans puis +++ après 80 ans
Survie
Médiane sans VI/trachéo = 20-48 mois
14% des cas, plus de 5 ans (Mateen et al JNNP 2010)

Génétique et SLA : les plus fréquentes
40 à 45 % des fALS et 6 à 8 % des sALS : expansion de
GGGGCC sur le chromosome 9 « C9 p21 »
Majounie et al, Lancet Neurol 2012 (USA Europe et Australie)
7% des sALS et 40% des fALS ; 6% des sFTD et 25% des fDFT
Étude Française (Millecamps et al, 2012) : 46% des fALS et 8% des sALS
phénotype = bulbaires, DFT avant la SLA, plus âgé et évolution plus rapide.
15 à 20 % des FALS et 3% des SALS : ALS1= mutation SOD
gain de fonction toxique de la SOD, enzyme antioxydante, qui ici mutée
entraîne une accumulation anormale dans le cytoplasme
Plus de 130 mutations, certaines non démontrées causales
Mutation 90A : début plus précoce évolution plus lente début MI, atteinte
pyramidale peu marquée, signes sensitifs
dans un même famille, même mutation, tableau clinique (SLA, ASP, atrophie
monomélique…)
20% sont dominantes
formes atypiques +++; pas de trouble cognitif, tableau périphérique “ pur ” ou
quelques troubles sensitifs ne doivent pas faire exclure le diagnostic.

Histoire naturelle de la SLA
1. les premiers signes (Kiernan et al, lancet 2011)
Perte de poids
Labilité émotionnelle
Douleurs (musculaires, crampes, contractures)
Fatigabilité d’effort
Déficit moteur progressif
Trouble du comportement

SLA et Métabolisme énergétique
Profil SLA =
Augmentation dépenses énergétiques et diminution des réserves
Facteur de protection :
Hyperlipidémie,
augmentation apolipoprotéine A (augmentation survie)
Diabète type 2 associé à un début plus tardif de SLA
Essais thérapeutiques en perspective :
Régime hypercalorique versus hypercalorique+hyperlipidique par la
gastrostomie
Utilisation olanzapine
5
Dupuis et al., Lancet Neurol 2011
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
1
/
43
100%