www.gendeaf.org Numéro 6, 2005 Bulletin du réseau européen de

www.gendeaf.org Bulletin n° 6
Numéro 6, 2005
Bulletin du réseau européen de GENetic DEAFness (sur la surdité génétique) : les mécanismes
pathogéniques, les diagnostics cliniques et moléculaires et l’impact social.
Ce bulletin est publié avec le soutien de la Commission européenne, le programme « Fifth
Framework » et le programme « Quality of Life and Management of Living Resources ».
LE COMITE DE RÉDACTION
Patrizia Ceccarani (Lega del Filo d’Oro onlus, Osimo) – Italie
Giancarlo Cianfrone, (AIRS – Associazione Italiana per la Ricerca sulla Sordità, Rome) - Italie
Christina Fasser (RETINA International, Zurich) - Suisse
Vibeke Leth (Danish Association for Cochlear Implanted Children, Skaevinge) - Danemark
Anders Lindgren - Sweden
Manuela Mazzoli (U.O.A. Otochirurgia, Padova) - Italie
Vanessa Migliosi (International Federation of Hard of Hearing Young People, Trento) - Italie
Milon Potmesil (The Palacky University, Pedagogical Faculty, Department of Special Education,
Olomuc) – République Tchèque
Chers lecteurs,
Au cours de ces deux années, le bulletin “Gendeaf News”, vous a tenu informés sur des thèmes
importants tels que la génétique et la surdité. Le Projet européen Gendeaf touche désormais à sa fin,
ainsi, pour marquer cet au revoir, nous avons voulu réaliser une édition spéciale du dernier numéro
de ce bulletin programmé.
Comme vous le savez, du 17 au 19 mars a eu lieu à Caserta, le Final Meeting du Projet Gendeaf.
Pour vous tenir au courant des dernières nouveautés de la recherche, les points essentiels de
certaines des interventions présentées au cours de la manifestation ont été publiées dans ce numéro.
En tant que professionnel, j’espère que ce travail de réseau et de synergie puisse se prolonger dans
le futur, combien même sous une autre forme.
Cordiales salutations
Patrizia Ceccarani
SYNTHÈSE DU FINAL MEETING OF THE EUROPEAN THEMATIC NETWORK ON
GENETIC AND DEAFNESS

www.gendeaf.org Bulletin n° 6
2
Du 17 au 19 mars 2005, s’est déroulé le “Final Meeting of the European Thematic Network on
GENetic DEAFness” à Caserta. Le programme des travaux a été organisé sous forme de tables
rondes et de rapports magistraux, de présentation de rapports libres et de posters. 250 experts
italiens et étrangers y ont participé. Ils ont abordés des thèmes importants, tels que la recherche en
biologie moléculaire (génotype-phénotype, mitochondrie, connexine 26), les pratiques cliniques,
l’impact social et communicatif sur les troubles génétiques, l’implant cochléaire, la surdité
syndromique et non.
On trouvera ci-dessous les points essentiels de certaines interventions.
GENE DE LA CONNEXINE 26
V. Migliosi, WP7
Vue d’ensemble de la génétique des connexines impliqués dans la surdité
Le gène de la connexine 26 est le gène de la connexine le plus souvent impliqué dans la surdité
récessive. En 1997, le travail réalisé par le D. P. Kelsell, à Londres, a montré que les mutations de
la connexine 26 étaient responsables jusqu’à 50% des cas de surdité récessive dans le bassin
méditerranéen. Une découverte très importante, car des travaux ultérieurs ont montré que les
mutations de la connexine 26 apparaissent également chez la plupart des autres populations : 30%
en Europe du Nord, 40% aux États-Unis d’Amérique, 22% au Brésil, 25% en extrême orient, 17%
au Ghana, et 15% en Australie. Ces pourcentages illustrent le fait que l’étude de la connexine 26 a
des implications pertinentes sur la diagnostique moléculaire et le soutien psychologique des
patients.
La plupart des mutations de la connexine 26 sont héritées selon un mode d’héritage récessif, bien
que des mutations rares peuvent causer soit des pertes d’audition dominante, soit des formes
syndromiques de surdité associée à des symptômes dermatologiques. À ce jour, plus de 80
mutations différentes de la connexine ont été identifiées ; elles sont répertoriées à la page d’accueil
Cx26-surdité (Cx26-deafness) de l’adresse Internet http://www.crg.es/deafness/cx26mut.php.
Avec le mode d’héritage récessif, les parents sont des porteurs sains avec deux copies de chaque
gène : l’un subi une mutation et l’autre non. Parce qu’il faut la présence de deux copies mutées pour
être malentendant, lorsque ces personnes ont des enfants, ils ont 25% de chances que leurs enfants
soient malentendants, et 50% de chances d’avoir des enfants avec une audition normale porteurs
d’une copie mutée et d’une copie normale. Avec le mode d’héritage dominant, il n’y a pas de
porteur sain. Ainsi, une copie mutée peut à elle seule causer une perte d’audition. Par exemple, un
parent malentendant n’ayant qu’une copie mutée et l’autre copie normale, se mariant avec un
partenaire dont l’audition est normale aura 50% de chances d’avoir un enfant malentendant et 50%
de chances d’avoir un enfant avec une audition normale.
En Europe, parmi les populations méditerranéennes, la mutation la plus fréquente de ce gène est
35delG, qui est responsable de 80% des mutations. Les fréquences des porteurs varient de 1/35
dans le sud de l’Europe à 1/79 dans le Nord de l’Europe. Cela veut dire qu’au moins 3% de la
population est porteur sain dans la zone Méditerranée.
La corrélation entre le type de mutation qui a lieu dans ce gène et le degré/sévérité de perte
d’audition n’est pas claire. Cependant, d’une manière générale, il semble que les personnes avec
35delG présentent dans les deux copies du gène présentent une perte significative d’audition plus
importante (sévère/profonde) que les patients avec une mutation 35delG et une mutation non-
35delG. Les personnes avec deux mutations non-35delG souffrent d’une perte auditive moins
importante (légère).
Parmi les autres populations, les mutations suivantes sont présentes avec une fréquence élevée : la
167delT chez la population juive ashkénaze, la 235delC chez les populations d’Extrême-Orient
(Japonais, Chinois et Coréens), la R143W au Ghana et la W24X chez les populations indiennes et

www.gendeaf.org Bulletin n° 6
3
roumaines (gypsies).
Le gène de la connexine 26 (BPJI2 – Bêta Protéine 2 de Jonction d’Intervalle ) encode une protéine
qui est une des six sous-unités identique jointes ensemble et formant un connexon, une moitié de
canal complet. Deux connexons sur des cellules opposées forment un canal de jonction d’intervalle
fonctionnel qui connecte deux cellules adjacentes et permet les passages de substances chimiques
comme l’ion potassium.
La connexine 26 est exprimée dans les cellules de soutien de l’organe de Corti et les cellules
épithéliales, dans les fibrocytes du limbus spirale et de la proéminence spirale et dans les cellules
intermédiaires et basales de la stria vascularis. Sa fonction n’est pas encore complètement comprise,
mais il se peut que ce soit d’aider à recycler en endolymphe les ions potassium qui entre dans les
cellules des cheveux par transduction sonore.
L’importance des autres connexines.
Il y a deux autres connexines dans la famille des protéines connexine, la 30 et la 31, similaires à la
26 et impliquées dans la surdité. La connexine 31 semble être responsable des deux types de surdité,
dominant et récessif, mais des travaux de recherche supplémentaire doivent être menés pour
avaliser cette théorie. Ainsi, nous voyons que des mutations différentes dans un même gène peuvent
causer des modes différents de surdité héréditaire. Le gène de la connexine 30 est situé très près du
gène de la connexine 26. Parce qu’une proportion élevée de patients malentendants (10%-42% dans
des populations différentes) sont porteurs d’une seule copie mutée dans la connexine 26, les
scientifiques font l’hypothèse que la seconde copie mutée peut être trouvée dans un gène proche de
la connexine 26. Ils ont trouvé que 50% des personnes sourdes qui avait seulement une mutation de
la connexine 26, étaient dépourvues d’un fragment de 309 kb de l’autre chromosome, qui éliminait
l'une des deux copies de la connexine 30. Cette mutation a été nommée suppression GJB6-
D13S1830. Une autre suppression de 232 kb (nommée GJB6-D13S1854), fut aussi identifiée, et
intervient dans 25% des cas qui demeurent non résolus après recherche de la suppression 309 kb. Le
reste des mutations des hétérozygotes de la connexine 26 affectés (10-30% des cas) demeure non
identifié. La découverte selon laquelle, dans l’oreille, les sous unités de la connexine 26 et 30 se
combinent pour former des jonctions d’intervalle fonctionnelles, illustre le rôle important de la
connexine 30.
De plus, la connexine 30 est responsable d’une forme dominante de surdité chez les nouvelles
familles. Il a été démontré qu’un autre gène appartenant à la famille de la connexine, la connexine
43 (GJA1), est responsable de la dysplasie dento oculo digitale (DDDO), un syndrome dominant
somatique, associé chez certains patients à une perte d’audition (défaillance dans l’oreille externe
ou moyenne). Par contraste, il est maintenant connu que les mutations de la connexine 45 ne
causent pas de surdité sensoneurinale non-syndromique comme rapportée en 2001.
Thérapie de la surdité de la connexine.
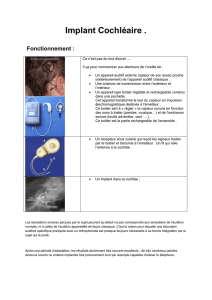
Une étude italienne a trouvé que les enfants profondément sourds avec mutations de la connexine
26 ont d’excellents résultats lorsqu’ils reçoivent les implants cochléaires et certaines preuves ont
conduit les chercheurs à émettre l’hypothèse que la perte de qualité n’est pas toujours congénitale.
Ceci voudrait dire qu’il existe une fenêtre temporelle primaire avant l’établissement de la déficience
finale, permettant l’entrée d’un signal sonore. Ceci pourrait expliquer les meilleurs résultats des
personnes sourdes ayant un implant de connexine 26. Une autre explication pourrait être que chez
les individus sourds avec connexine 26, les cellules du ganglion spiral ne sont pas affectées par les
mutations. Une étude intéressante a été réalisée en Israël; elle comparait les capacités d’élocution
des enfants implantés porteurs de mutations de la connexine 26 à ceux dont l’étiologie est
inconnue. Il n’y avait aucune différence significative parmi les résultats, de perception de
l’élocution entre les deux groupes.
D’une manière générale, ces découvertes mettent en relief l’importance que le conseil génétique, la

www.gendeaf.org Bulletin n° 6
4
détection précoce, et le diagnostique ont aujourd’hui pour obtenir les meilleurs résultats de
réhabilitation. Dans le futur, comprendre les fonctions de la connexine dans l’oreille pourrait
améliorer les traitements actuels ou même conduire au développement de nouvelles thérapies.
L’IMPACT SOCIAL ET COMMUNICATIF DANS LES CAS DE TROUBLES GENETIQUES
P. Ceccarani, WP 7
De nombreuses et intéressantes interventions ont cherché à mettre en évidence l’importance de tenir
compte des effets sociaux et psychosociaux de la surdité, syndromique ou non.
La connaissance et la reconnaissance des syndromes qui provoquent la perte d’audition sont
importantes, non seulement pour les parents, les oto-rhino-laryngologistes et les audiologistes, mais aussi
les enseignants, les logopédistes, les psychologues, les pédiatres et autres professionnels qui
travaillent avec les personnes souffrant de problèmes auditifs. L’implication des associations de
personnes handicapées et de la famille dans un engagement commun avec des professionnels
permet notamment d’améliorer la qualité de vie quotidienne des personnes hypoacousiques pour des
raisons génétiques.
Les pertes d’audition dues à des syndromes représentent 30% chez les enfants sourds (Grundfast
1993). Généralement, d’autres organes sont impliqués dans la surdité syndromique, ainsi les
malformations crio-faciales, squelettiques, le déficit oculaire, neurologique, dentaire,
cardiovasculaire, etc. sont également mis en évidence.
Un diagnostique correct et rapide d’un syndrome, et donc également de l'aspect génétique comme
dans le cas du syndrome d’Usher ne sert pas seulement à définir le modèle héréditaire, mais permet
également de comprendre les anomalies des autres organes associés et d’intervenir de manière
adéquate. Il permet donc de repérer le plus tôt possible les symptômes susceptibles de se présenter,
la dégénération de certains comportements et donc de prévenir certains effets négatifs dépendants
de l’hypoacousie et du déficit visuel associé à temps.
En quoi les personnes hypoacousiques sont-elles limitées au niveau des divers aspects de la vie?
Selon l’ampleur du syndrome, la personne peut avoir plus ou moins de difficulté à s’intégrer, aussi
bien des points de vue de la vie quotidienne que professionnelle. En effet, elle se retrouve
confrontée chaque jour à de nombreux problèmes, tels que le manque d’accès aux informations, la
difficulté de contact, de communication et d’interaction avec la famille et les autres personnes, le
risque de perdre son emploi, de se retrouver isolée socialement et culturellement, les obstacles à la
mobilité indépendante et au temps libre.
Une communication efficace est fondamentale pour toutes les fonctions de l’être humain, la
présence de problèmes au niveau communicatif réduit les rapports et les opportunités sociales,
augmente le stress et l’anxiété, et amène à se construire une image négative de soi-même. Il est
donc essentiel et important de rapidement repérer, identifier et suivre un traitement de réhabilitation
des troubles du langage.
Dans la plupart des cas de troubles du langage, on ne comprend pas toujours la provenance. Bien
souvent, c’est la perte d’audition qui provoque la difficulté de parole et de développement (la
surdité peut être définie comme une perte suffisante, au point de rendre la parole difficile ou
impossible sans soutien mécanique), d’autres fois, elle tient à l’incapacité d’apprendre, les
paralysies cérébrales, le retard mental et le bec de lièvre.
Au cours de ces dernières décennies, la génétique a enregistré de grands progrès et les mécanismes
qui peuvent causer des troubles du comportement, du langage et de l’audition ont été décrits.

www.gendeaf.org Bulletin n° 6
5
Notamment, l’importance du rôle des facteurs génétiques a été reconnue chez les enfants présentant
des troubles spécifiques de la parole - en effet, une hérédité concernant un trouble spécifique de la
parole et la concordance chez les jumeaux homozygotes semblerait augmenter le risque de ce
développement. Les problèmes de langage ne dépendent pas toujours d’un seul trouble génétique,
mais semblent plutôt être causés par l’interaction de différents gènes et de facteurs
environnementaux.
Ceci peut être interprété comme un trouble complexe, la combinaison exacte des gènes qui
déterminent le trouble spécifique du langage peut varier d’un individu à un autre, bien que certains
sujets puissent ne pas développer le problème.
Le développement de la parole, d’un système de communication, une compréhension différente de
la langue aussi bien écrite que parlée peuvent être conditionnés par le fait que l’hypoacousie soit
acquise ou de naissance (syndrome de Charge, syndrome de Goldenhar, etc.), ou qu’une pathologie
associée soit à l’origine (syndrome de Usher : hypoacousie congénitale, dystrophie rétinienne
progressive).
L’apprentissage des codes de communication non verbaux, aussi bien au niveau expressif que
réceptif, dépend des capacités sensorielles résiduelles de la personne et des limitations qui leur sont
associées. Les systèmes non verbaux peuvent être divers.
Un objet, s’il est associé à une activité spécifique (parce que par exemple il la rappelle où est utilisé
pour l’action en elle-même), peut fournir à l’enfant les informations nécessaires lui permettant de
comprendre de quoi on est en train de parler et ce qu’il doit faire, et se transforme ainsi en un code
de communication ; même une couleur, un objet ou un modèle peuvent communiquer une action,
une situation de danger, etc.
Si la personne possède la capacité de discriminer des images, elle peut utiliser la communication
pictographique et si elle a la notion de temps, les mêmes images peuvent être insérées dans un
agenda ou un calendrier pour lui permettre de contrôler les divers rendez-vous.
Dans le langage des signes, comme dans la langue orale, il y a des structures et des règles
grammaticales, nous faisons en fait référence à : la configuration et la position que la main adopte
dans la réalisation des signes ; le lieu où sont opérés les signes ; le mouvement effectué ; les
composants non manuels comme l’expression faciale ou le déplacement des lèvres.
Dans la dactylographie, qui est souvent associée au langage des signes, les mouvements et les
positions des doigts de la main diffèrent pour chaque lettre de l’alphabet.
Les personnes qui ont perdu également la vue en plus de l’ouïe peuvent utiliser le Malossi. Dans ce
système, on considère la main qui reçoit le message comme une espèce de machine à écrire.
Toucher légèrement ou pincer la main en des points bien déterminés, correspond à une lettre précise
de l’alphabet.
Souvent, les différents codes de communication et les divers langages non verbaux sont utilisés de
manière intégrée, car l’objectif principal est celui de satisfaire au besoin de communication.
Il peut y avoir plus de chances de communiquer si la personne malentendante ou sourde et aveugle
peut avoir recours à un interprète, une personne de contact, un téléphone avec DTS, un ordinateur
avec barre braille, un vidéo-agrandisseur, etc.
Une prothéisation acoustique adaptée et précoce (dans les 6 mois qui suivent la naissance), ou un
implant cochléaire ne peuvent qu’augmenter la capacité auditive et avoir, par conséquent, des effets
positifs sur l’interaction de l’enfant avec l’environnement et éviter les troubles du langage et le
retard qui en découle au niveau du développement.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%