6 pages A. Le lieu de synthèse : le follicule La biosyn

Hormonologie - Reproduction – Biosynthèse et mode d'action des hormones thyroïdiennes
19/02/15
CIMIGNANI Julie L3
Hormonologie - Reproduction
Pr Barlier
CR :
6 pages
Biosynthèse et mode d'action des hormones thyroïdiennes
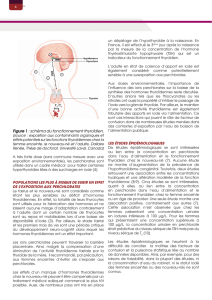
A. Le lieu de synthèse : le follicule
La biosynthèse des hormones thyroïdiennes est strictement dépendante des follicules thyroïdiens.
Entre les cellules thyroïdiennes il y a des jonctions serrés donc c'est complètement hermétique, du coup il faut
forcement transiter par la cellule.
Structure du follicule thyroïdien :
Il y a au centre la lumière folliculaire entourée de thyrocytes, qui sont des cellules polarisées avec un pôle
baso-latéral et un pôle apical.
Le follicule thyroidien synthétise les hormones à l'intérieur de la lumière folliculaire
La synthèse des hormones thyroïdiennes met en jeu des réactions chimiques très liées à la structure du
follicule thyroïdien qui présente différentes zones (lumière folliculaire, etc.). Cette synthèse hormonale est donc
dépendante de la structure du follicule .
1/6
Plan
A. Le lieu de synthèse : le follicule
B. Les hormones thyroïdiennes
C. Biosynthèse des hormones thyroïdiennes
I. 1ère étape = capture d'iodure circulant
II. 2ème étape = organification de l'iode
III. 3ème et dernière étape = nouvelle internalisation de la TG dans le thyrocyte
D. Distribution et métabolisme des hormones thyroïdiennes
E. Transporteurs membranaires
F. Mécanisme d'action des hormones thyroïdiennes

Hormonologie - Reproduction – Biosynthèse et mode d'action des hormones thyroïdiennes
B. Les hormones thyroïdiennes :
Les hormones thyroïdiennes possèdent une même structure organique, la thyronine formée de 2 noyaux
aromatiques reliés par un pont ester.
C'est le nombre et la place des atomes d'iodes qui différencient entre elles les différentes hormones
thyroïdiennes. (entouré)
elles sont synthétisées a partir de la tyrosine trouvé sur la tyroglobuline situé a l'intérieur du follicule thyroïdien.
On en différencie 3 types :
–la T4 = thyroxine avec 4 atomes d'iode
–la T3 = triiodothyronine
–et la reverse T3 (qui est la forme inactive des hormones thyroïdiennes.)
Cette synthèse des hormones thyroïdiennes passe par 2 précurseurs qui sont
•Le MIT = 3 mono-iodotyrosine (avec un seul atome d'iode),
•Le DIT = 3,5 Di-iodotyrosine (avec 2 atomes d'iode).
Ces résidus tyrosine MIT et DIT vont être localisés sur la thyroglobuline.
C. Biosynthèse des hormones thyroïdiennes
Il y a 4 molécules indispensables à cette biosynthèse des hormones thyroïdiennes (sont requises sur la
membrane apicale pour iodé les résidus tyrosine de la tyroglobuline) :
•l'iodure (iode ionique)
•la thyroglobuline (TG)
•l'eau oxygénée H2O2 (+ enzymes nécessaires à sa production)
•la thyroperoxydase (TPO)
I. 1ère étape = capture d'iodure circulant
La capture d'iodure circulant se fait au pôle basal du thyrocyte grâce au symporteur Na+ /I- (= NIS) ( il peut
fonctionner grâce a un gradient électrochimique entre l'extérieur et l'intérieur de la cellule de Na+) dont la
fonction est de coupler l'absorption d'1 anion iodure (I-) et de 2 cations sodium (Na+).
Ce symporteur est lié à une autre enzyme, la Na+/K+-ATPase.
Cette NA/K-ATPase va faire sortir 3 Na+ et faire rentrer 2 K+.
On va aboutir à un gradient électrochimique qui va attirer les ions Na+ à l'intérieur de la cellule puisqu'il va y
avoir plus de charges positives à l'extérieur qu'à l'intérieur de la cellule.
C'est un mécanisme actif ATP dépendant.
Il existe des mutations de ce NIS et aboutit a une hypothyroïdie.
NIS est imparfaite elle peut faire rentrer le perchlorate de pertechnate (scintigraphie au technecium).
==> Création d'un gradient électrochimique, les Na+ vont avoir tendance à rentrer dans la cellule et c'est ce
gradient qui va entraîner l'iode (avec le NIS).
Ces 2 protéines intra-membranaires (NIS et NA+/K+ ATPase) sont donc extrêmement liées. On peut dire que le
transport d'iode est ATP-dépendant car il a besoin de cette enzyme pour créer le gradient.
2/6

Hormonologie - Reproduction – Biosynthèse et mode d'action des hormones thyroïdiennes
PATHOLOGIES :
Il existe des mutations de ce NIS qui donnent des hypothyroïdies congénitales car entrainant une incapacité à
capter l'iode.
Cette pompe iodure est imparfaitement sélective car pouvant faire entrer une autre molécule très importante
dans le diagnostic de pathologies thyroïdiennes : le perchlorate de pertechnate qui est marqué au
technetium99.
La scintigraphie au Tc99 est utilisées dans les explorations d'hyperthyroïdie (pour le diagnostic différentiel
entre un adénome toxique et la maladie de Basedow) en raison des propriétés de cette pompe à l'iode qui permet
de faire rentrer cette molécule de perchlorate de pertechnate.
On peut faire des scintigraphie à l'iode, mais c'est plus cher et moins facile à manipuler car moins stable.
Les besoins en iode :
•enfant : 100 µg
•adulte : 100 - 150 µg
•grossesse ou allaitement :100 - 300 µg, maintenant on préconise pour les femmes enceintes de prendre
de l'iode. Les hormones thyroïdiennes sont très importantes dans le développement cérébral de
l'enfant.
Dans les montagnes on a parlé des « crétins des alpes » qui sont des gens qui ont vécu dans les montagnes où il
y a un manque d'iode, et donc hypothyroïdie par manque d'iode et de génération en génération, on va avoir un
problème de développement cérébral (gros goïtre).
Depuis 1952 on a rajouté de l'iode dans le sel de cuisine.(pour pallier au manque d'iode dans la population)
Une fois capté, l'iode traverse ensuite toute la cellule pour aller jusqu'au pôle apical qu'elle doit traverser via un
processus actif, par des canaux appelés « pendrine » et AIT (transporteur d'iode sur le pole apicale) = moins
bien connu.
Ainsi l'iode est libéré dans la lumière folliculaire.
II. 2eme étape = organification de l'iode
L'iode minéral I- est transformé en iode organique au niveau de la membrane apicale, sur le pole apical à
l'interface entre le thyrocyte et la lumière folliculaire.
Pour ça il faut des protéines :
•La 1ère est la thyroglobuline (TG) qui est une protéine acceptatrice des atomes d'iodes, très
volumineuse.
Elle est synthétisée spécifiquement par les thyrocytes ( pour surveiller le cancer du seins= dosage de la
thyroglobuline) sous le contrôle de la TSH et va être stockée dans la lumière folliculaire.
La TG est une énorme protéine avec beaucoup (une centaine) de résidus tyrosines dont 25-30 vont être
iodés et ensuite seulement la moitié vont servir pour la synthèse des hormones thyroïdiennes.
Donc cette TG constitue une réserve d'iode dans l'organisme car tout ne va pas être utilisé pour
synthétiser les hormones thyroïdiennes.
•La 2ème est la thyroperoxydase (TPO) qui est liée à la membrane et qui a une longue partie dans la
lumière folliculaire.
C'est l'enzyme clé de l'hormonosynthèse.
Pour acquérir son activité optimale, elle a besoin de l'H2O2 qui est produite par la NADPH
oxydase/Duox2.
Duox2 indispensable pour la synthèse de l'eau oxygénée.
3/6

Hormonologie - Reproduction – Biosynthèse et mode d'action des hormones thyroïdiennes
NADPH + O2 + H+ ==> NADP+ + H2O2
La TPO ne peut oxyder ses substrats que si elle a été elle même oxydée une molécule d'H2O2 .
La TPO, comme la thyroglobuline, est une protéine spécifiquement thyroïdienne dont la synthèse est contrôlée
par la TSH.
==> TSH contrôle la synthèse de la thyroglobuline (TG) et de la thyroperoxydase (TPO)
La TPO va pouvoir agir
–soit en oxydant un I- pour permettre sa liaison à un résidu tyrosine de la TG,
–soit en oxydant un couple d'iodo-tyrosine hormonogénique déjà formé pour former une iodo-thyronine.
On a une tyroSine, ce qu'il faut c'est obtenir une thyroNine.
Donc la TPO va soit mettre un atome d'iode sur la tyroSine. Soit elle va utiliser des tyrosines déjà iodées pour
former de la thyroNine.
La TPO, grâce à l' H2O2, oxyde l'atome d'iode pour transformer I ==> I- + IOH et ce IOH va pouvoir s'accrocher
sur le résidu tyrosine (et ainsi former une thyronine)
Donc, dans la lumière folliculaire, on va avoir une thyroglobuline TG qui va être chargée en thyronine qui
comporte des atomes d'iode grâce à la thyroperoxydase TPO.
III. 3ème et dernière étape : nouvelle internalisation de la TG dans le thyrocyte
L'entrée de la thyroglobuline (TG) dans la cellule dépend des besoins de l'organisme.
Ce passage très régulé va se faire par 2 phénomènes :
–phagocytose (ou macropinocytose) ou par
–endocytose (ou micropinocytose.)
Une fois entrée, la molécule de TG est hydrolysée dans les lysosomes par des endopeptidases ou des
exopeptidases afin de libérer la T3 et la T4 accrochées sur cette TG, elles vont pouvoir être sécrété en
extracellulaire et aller dans le circuit sanguin.
L'iode est un oligo-élément relativement rare dans l'environnement, ce qui explique la mise en place dans la
cellule d'un système de récupération de l'iode non utilisé.
Il existe un système de recyclage de ces précurseurs des hormones thyroïdiennes (MIT et DIT).
Ce qui n'a pas été transformé en thyronine est recyclé.
Ce recyclage utilise une enzyme une iodotyrosine desiodase (enlève les iodes) appelée la déshalogenase.
Ces hormones thyroïdiennes passent dans la circulation sanguine en passant par un transporteur MCT8
(mécanisme actif) entre le compartiment basal et le compartiment sanguin qui permet la sécrétion des hormones
thyroïdiennes.
PATHOLOGIE
Il existe des mutations :
–de la TPO qui sont responsables de la majorité des hypothyroïdies congénitales avec troubles de
l'organification de l'iode
–de Duox2 sont associé a des hypothyroïdie congénitale.
–de MCT8 responsable d'hypothyroïdie congénital.
–maladie d'Hashimoto : production d'AC anti TPO entrainant la destruction de la propre glande
thyroïdienne du patient (hypothyroïdie), on dose donc ces AC.
4/6

Hormonologie - Reproduction – Biosynthèse et mode d'action des hormones thyroïdiennes
D. Distribution et métabolisme des hormones thyroïdiennes
Ces hormones sont hydrophobes et donc liées a des protéines de transport comme l'albumine ou spécifiques
comme la TBG (Thyroxine Binding Globulin) ou la TBA (Thyroxine Binding pre Albumine).
La forme active des hormones thyroïdiennes est la fraction libre mais c'est une partie très très minoritaire
(0,03%) pour la T4 et (0,03%) pour la T3.
Lors d'un dosage, on dose les formes libres ( FT4 = free T4 ).
La totalité de la T4 circulante provient de la production thyroïdienne alors que la grande partie de la T3 est
issue de la conversion périphérique de la T4 en T3.
On peut presque considérer la T4 comme une pro hormone.
Transformation de T4 en T3 par des desiodases qui sont des seleno protéines.
Il en existe plusieurs types :
•La 5' desiodase de type 1 absente du SNC et son activité est diminuée en cas d'hypothyroïdie.
•La 5' desiodase de type 2 présente dans le SNC et son activité est majorée en cas d'hypothyroïdie.
On a vu que les hormones thyroïdiennes sont très importantes pour le SN.
Grâce aux desiodases de type 2, même en cas d'hypothyroïdie, il va y a voir un taux de T3 conservé.
•La 5' desiodase de type 3 qui a juste un rôle d'inactivation, elle transforme T4 en RT3 i.e. en T3 inactive.
F. Mécanisme d'action des hormones thyroïdiennes
1972 : Oppenheimer découverte de sites nucléaires liant les hormones thyroïdiennes avec une haute affinité.
1986 : clonage et caractérisation de ces récepteurs (homologie avec l'oncogène virale)
Les récepteurs des hormones thyroïdiennes sont des facteurs de transcription.
Ce sont des récepteurs nucléaires (appartenant à la superfamille des récepteurs nucléaires) avec des domaines
très importants et dont la structure est toujours identique.(oetradiol,testosterone,cortisone,aldosterone...) :
–liaison a l'hormone
–liaison a l'ADN
–domaine charnière (important dans les hormones thyroïdienns)
–2 domaines de transactivation : AF1 = independant de l'hormone alors que celui en C term est dependant
de l'hormone.
Il existe plusieurs isoformes de récepteurs nucléaires.
Il existe en effet 2 grands gènes TR α et TR β situés sur des chromosomes différents, chacun de ces 2 gènes
donnant 2 isoformes.
Par des phénomènes d'épissage alternatif, TR α donne TR α 1 et 2 (chromosome 17) et TR β donne TR β
donne TR β 1 et 2 (chromosome 3).
==> 2 gènes avec 2 isoformes chacun.
On a donc 4 récepteurs mais le TRα2 n'est pas vraiment un récepteur aux hormones thyroïdienne car il n'a pas
de site de liaison à l'hormone, c'est plutôt un régulateur negatif (on ne sait pas trop).
Ils ont une expression spécifique tissulaire = sectorisation (ils ne sont pas ubiquitaire) c'est à dire que selon les
tissus, la proportion des différentes isoformes de récepteurs nucléaires est différente, ce qui a son importance
en pathologies (mutation des R des hormones thyroïdiennes = uniquement inactivatrice) une résistance
hormonale n'est jamais a 100% souvent c'est une découverte fortuite car il n'y a jamais trop de symptôme chez
le patient, on aura une augmentation des hormones thyroïdiennes (cliniquement soit le patient est normal soit il
est en hypothyroïdie)
Dans la maladie de Basedow soit la TSH est normal ou élevée et T3/T4 elevé = complication cardiaque sévère
et déficience cérébral du a la sectorisation des hormones thyroïdiennes.
5/6
 6
6
1
/
6
100%