3.correction bmcp 18_02

BMCP – Apoptose ou mort cellulaire programmée
18/02/2014
LETOUCHE Marie-Lou L2
BMCP
Pr. M. GASTALDI
marguerite.gastaldi@univ-amu.fr
18 pages
Relecteur n°3
Apoptose ou mort cellulaire programmée
1/18
Plan :
A. Introduction – Définition
B. Description morphologique et biochimie
C. Mécanismes moléculaires
I. Gênes de l'apoptose : de C. elegans aux mammifères
II. Les caspases
III. Ced-4 et ses homologues
IV. La famille Bcl-2
V. Mitochondries et cytochrome C
VI. Nucléases
VII. Les récepteurs de mort cellulaire
VIII. Régulation de l'apoptose
D. Exemples d'apoptose
E. Conclusion : apoptose et pathologies

BMCP – Apoptose ou mort cellulaire programmée
A. Introduction - Définition
L'apoptose est un mécanisme au cours duquel les cellules meurent (physiologique et pathologique).
→ Pourquoi avons-nous eu un intérêt tardif pour la mort cellulaire (années 90) ?
Historique : (il n'y aura pas de question dessus mais il permet de mieux comprendre le phénomène)
1842 : C'est un processus normal au cours du développement des vertébrés (Vogt).
1951 : Gluckman en fait une description morphologique grâce au développement des techniques.
1964 : On emploi le terme de « mort cellulaire programmée » chez les invertébrés qui est un processus
prévisible dans des tissus donnés à des stades précis du développement.
1969 : On fait un parallèle morphologique chez les vertébrés et les invertébrés. On fait l'hypothèse qu'il existe un
processus commun entre ces deux groupes.
1972 : A partir de maintenant ça s'accélère. On utilise le terme d'apoptose chez les vertébrés par analogie avec la
chute des feuilles des arbres en automne.
1974 : C'est un phénomène biochimique avec activation d'enzymes et de dégradation de l'ADN.
Les endonucléases sont identifiées seulement 23 ans plus tard !
1982 : La description d'un programme génétique spécifique est faite (C. elegans).
1988 : Il y a identification de la protéine Bcl-2 qui est une protéine anti-apoptotique chez les mammifères. Bcl-2
est une des protéines analogues aux vers et aux mammifères.
Depuis, on a découvert l'implication d'altérations de l'apoptose au cours de nombreuses pathologies chez
l'homme.
Importance physiologique de l'apoptose :
La vie ne peut exister sans mort des cellules et la régénération de nouvelles cellules au cours du temps !!
L'apoptose est un processus normal au cours de :
•développement des organismes pluricellulaires
•homéostasie tissulaire (renouvellement tissulaire : nombre de cellules néo-formées comparable au nombre
de cellules qui disparaissent)
•défense contre des agents pathogènes
Donc c'est un processus normal tout au long de la vie et pas seulement pendant le développement.
Apoptose et développement... :
→ Modelage d'organes :
–Formation des doigts et espaces interdigitaux : ces espaces doivent disparaître par apoptose.
–Mise en place d'une cavité au sein d'un organe initialement plein (cavité pré-amniotique) par apoptose des
cellules au centre de cet organe.
→ Elimination de structures : Elimination de structures “vestiges” nécessaires à une espèce ancestrale :
–à un stade donné du développement (ex : la queue du têtard)
–dans un sexe donné (ex : les canaux de Muller éliminés chez les mâles et les canaux de Wolf éliminés chez
les femelles)
2/18

BMCP – Apoptose ou mort cellulaire programmée
→ Ajustement du nombre de cellules :
50% des neurones et des cellules gliales vont mourir au cours du développement du système nerveux.
→ contrôle de la qualité des cellules :
–Elimination des cellules anormales, non fonctionnelles, mal localisées ou dangereuses pour l'organisme
(95% des cellules du système immunitaire).
–Elimination des cellules endommagées ne pouvant être réparées
3/18

BMCP – Apoptose ou mort cellulaire programmée
… Mais aussi dans les tissus adultes :
Elle permet le maintien de l'homéostasie. Il y a un équilibre entre prolifération et mort cellulaire.
Le corps humain détruit environ 60 x 10
9
cellules par jour par apoptose en réponse à des stimuli physiologiques,
pathogènes ou cytotoxiques. C'est autant de cellules qui devront être renouvelées !
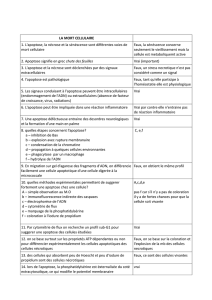
B. Description morphologique et biochimie
Ce schéma est à savoir ++++++ !
-L'apoptose est un processus actif, il est donc énergie-dépendant (ATP dépendant) et met en jeu des synthèses
protéiques. Elle est permise pas l'activation de cascade enzymatiques spécifiques (caspases).
-Elle implique la translocation des résidus de phosphatidylsérine PS (phospholipide complexe qu'on retrouve au
niveau des membranes cellulaires et particulièrement au niveau de la membrane interne et qui donc dans ce
processus d'apoptose passe du côté externe de la membrane). C'est d'ailleurs un bon moyen de mettre en évidence
l'apoptose. Il y a également modification de la perméabilité des mitochondries et libération de facteurs
mitochondriaux dans le cytosol. On peut aussi noter la fragmentation spécifique de l'ADN, internucléosomique.
→ Il est important de savoir que l'apoptose n'est pas une réaction inflammatoire !
✔Mise en évidence de l'apoptose : Effet de TUNEL
Elle utilise la mise en évidence de la fragmentation de l'ADN.
On met en culture des cellules avec une enzyme particulière, la terminale transferase, qui permet de rajouter au
niveau des extrémités 3'-OH libres du dUTP marqué qui va combler les coupures de l'ADN lors de sa dégradation
(phénomène systématique lors de l'apoptose).
Seuls les noyaux apoptotiques sont mis en évidence, on peut alors quantifier les cellules apoptotiques (et effectuer
le calcul d'un pourcentage).
4/18

BMCP – Apoptose ou mort cellulaire programmée
✔Mise en évidence de l'apoptose : Iodure de propidium et cytométrie de flux
La cytométrie de flux est un trieur de cellules en fonction de la taille et de l'existence ou non du marqueur.
Le principe repose sur la coupure entre les nucléosomes et donc sur l'ADN fragmenté.
On va effectuer une quantification avec un fluorochrome intercalant spécifique, par exemple l'iodure de
propidium (IP).
On met en culture des cellules perméabilisées et de l'IP et on analyse en cytométrie de flux.
La plupart des cellules sont en phase G1 (étape la plus longue) où les cellules sont diploïdes (2n).
→ Ce qu'il faut retenir ce que le pic des cellules apoptotiques a une quantité d'ADN < à n (cellules
normales).
✔Mise en évidence de l'apoptose : Annexine V
Ici, on détecte les flip-flop des PS de la membrane plasmique par l'annexine V couplée au fluorochrome.
Lors de l'apoptose, la PS est transloquée de la face cytosolique à la face extracellulaire de la membrane plasmique.
5/18
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%