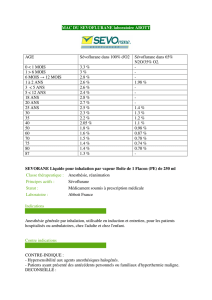
Le sévoflurane en anesthésie adulte

LE SEVOFLURANE EN ANESTHESIE ADULTE
B. Debaene, B. Plaud, Service d'Anesthésie, Institut Gustave Roussy,
94805 Villejuif Cedex, France.
INTRODUCTION
Le sévoflurane est commercialisé en France depuis environ deux ans. Ses
caractéristiques pharmacodynamiques sont actuellement bien connues et finalement
assez proches de celles de l'isoflurane. Au cours de ces deux dernières années, le
métabolisme et la toxicité du sévoflurane ont été plus particulièrement étudiés.
L'induction au masque avec le sévoflurane a été décrite chez l'adulte et les qualités
du réveil après sévoflurane ont été comparées à celles de l'isoflurane et du propofol.
Ces deux aspects de l'anesthésie au sévoflurane chez l'adulte : métabolisme et
toxicité d'une part, et induction au masque et réveil d'autre part sont abordés dans
cet article.
1. METABOLISME ET TOXICITE DU SEVOFLURANE
Le sévoflurane est métabolisé principalement par le foie, mais il est également
dégradé par les absorbants du CO2 (utilisés dans les circuits anesthésiques avec
réinhalation).

MAPAR 1997
120
1.1. METABOLISME DU SEVOFLURANE
1.1.1. METABOLISME HEPATIQUE DU SEVOFLURANE
5 % de la dose de sévoflurane administrée sont métabolisés contre 75 % pour le
méthoxyflurane, 40 % pour l'halothane, 5 % pour l'enflurane, 0,2 % pour l'isoflurane
et seulement 0,02 % pour le desflurane. La biotransformation hépatique du
sévoflurane est sous la dépendance quasi exclusive du cytochrome P450 2E1
responsable d'une défluorination [1]. Alors que cet isoforme est présent au niveau de
l'hépatocyte, il est pratiquement absent de la cellule tubulaire rénale. Par ordre
décroissant, la défluorination des halogénés est la suivante : méthoxyflurane >
sévoflurane > enflurane > isoflurane > desflurane > 0 [2].
Ce métabolisme hépatique produit d'une part des ions fluor et d'autre part de
l'hexafluoroisopropranol (ou HFIP) qui est immédiatement glucuro-conjugé et
éliminé par les urines. Du fait de cette glucuro-conjugaison, le HFIP n'est
responsable d'aucune hépatotoxicité. La production de fluor inorganique est d'autant
plus importante que la concentration inhalée du sévoflurane est élevée et que sa
durée d'administration est prolongée.
Le métabolisme hépatique du sévoflurane ne conduit pas à la production d'acide
trifluoro-acétique (TFA). Ceci le différencie de tous les autres agents halogénés
commercialisés (halothane, enflurane, isoflurane et même desflurane). Ainsi,
l'hépatotoxicité immuno-allergique médiée par le TFA, de même qu'une
hépatotoxicité croisée, est improbable après l'utilisation du sévoflurane [3].
Le sévoflurane peut donc être utilisé de préférence lors d'anesthésies répétées.
1.1.2. METABOLISME RENAL DU SEVOFLURANE
La concentration de l'isoforme P450 2E1 étant très faible dans la cellule
tubulaire rénale, la défluorination rénale du sévoflurane est minime. In vitro, la
vitesse de production rénale de l'ion fluor est de 0,05 nmol/mg/h contre 4 nmol/mg/h
pour l'hépatocyte [2,4].
1.2. DEGRADATION DU SEVOFLURANE PAR LES ABSORBANTS DU CO2
Comme l'halothane, le sévoflurane est dégradé par les absorbants du CO2 utilisés
dans les circuits avec réinhalation. Le produit de dégradation (qui n'est pas un
métabolite) est connu sous le nom de « composé A » (ou fluoromethyl-2,2-difluoro-
1-(trifluoromethyl)vinyl éther).
Le composé A est formé en quantité faible dans les circuits d'anesthésie lors de
l'administration du sévoflurane chez l'homme. Cependant, la concentration du
composé A dépend de nombreux facteurs :
-la concentration télé-expiratoire du sévoflurane : plus celle-ci est élevée, plus la
concentration du composé A augmente ;
- le débit de gaz frais : plus il est bas, plus la production de composé A est élevée ;
-le type d'absorbant : la chaux barytée produit plus de composé A que la chaux
sodée (le seul absorbant disponible en France) ;
-le degré d'hydratation de la chaux : plus elle est déshydratée, plus la production de
composé A est accrue ;

Nouveaux médicaments
121
-la température du canister : plus elle est élevée, plus la concentration de composé
A augmente ;
- la production du CO2 : la concentration du composé A augmente avec la VCO2.
Le composé A est conjugué au glutathion, puis est métabolisé via une ß-lyase
(enzyme concentré dans la cellule tubulaire proximale) pour former des radicaux
hautement réactifs responsables de lésions tubulaires proximales, chez le rat [5].
1.3. TOXICITE RENALE DU SEVOFLURANE
La toxicité rénale du sévoflurane peut être due à deux mécanismes :
- la toxicité du fluor inorganique ;
- la toxicité rénale du composé A
1.3.1. TOXICITE RENALE DU FLUOR INORGANIQUE
La toxicité rénale du fluor a été initialement mise en évidence lors de l'utilisation
du méthoxyflurane. Une concentration plasmatique de fluor supérieure à 50 µmol/l
définissait alors le seuil toxique d'atteinte rénale, et une concentration supérieure à
90 µmol/l était responsable d'une insuffisance rénale sévère [6]. Cette définition du
seuil de néphrotoxicité, si elle est vraie après administration du méthoxyflurane, a
été appliquée à tous les agents anesthésiques fluorés pour en faire un dogme.
Cependant, ce dogme a été pris en défaut lors de l'administration de l'enflurane, de
l'isoflurane (sur une période prolongée), et du sévoflurane. En effet, avec ces trois
agents, une concentration de fluor supérieure à 50 µmol/l ne s'est pas accompagnée
d'une insuffisance rénale. Très récemment, la néphrotoxicité du fluor a trouvé une
explication dans la production intrarénale de fluor, secondaire au métabolisme
intrarénal des agents halogénés. L'équipement enzymatique de la cellule rénale
(cytochrome P450) autorise un tel métabolisme, particulièrement celui du
méthoxyflurane. Le sévoflurane n'étant métabolisé que par un seul isoforme du
P 450, l'isoforme 2E1, quasiment absent du microsome rénal, la production
intrarénal de fluor lors de l'administration de cet agent est trop faible pour prétendre
induire une éventuelle néphrotoxicité [4]. Ceci a été confirmé chez l'homme lors
d'anesthésie de longue durée (condition expérimentale nécessaire à l'obtention d'une
concentration plasmatique de fluor supérieure à 50 µmol/l).
En l'absence d'insuffisance rénale, après une anesthésie d'une durée supérieure à
400 minutes utilisant un débit de gaz frais élevé (6l/min) et une concentration
cumulée de sévoflurane supérieure à 9 CAM/h, la concentration de fluor
plasmatique était significativement plus élevée chez les patients recevant du
sévoflurane (55,8 ± 3,4 µmol/l ; n = 8) que chez ceux recevant de l'isoflurane
(4,8 ± 0,5 ; n = 11) (m ± SEM). Malgré cette différence, la fonction rénale de ces
patients, estimée sur l'urée et la créatinine plasmatique ainsi que sur la capacité à
concentrer les urines, était comparable entre les deux groupes de traitement dans la
période postopératoire [7].
La toxicité du fluor a été également étudiée chez 14 patients insuffisants rénaux
(clairance de la créatinine = 30 ml/min) au cours d'une anesthésie au sévoflurane
(n = 7) ou à l'isoflurane (n = 7), avec un débit de gaz frais de 6l/min. La durée de

MAPAR 1997
122
l'anesthésie était comparable entre les deux groupes (plus de 300 minutes), ainsi que
la concentration des agents anesthésiques (5 CAM/h). Fort logiquement, la
concentration plasmatique de fluor était plus élevée après sévoflurane
(52,0 ± 9,8 µmol/l, m ± SEM) qu'après isoflurane (8,2 ± 2,2 µmol/l) [8]. Cependant,
la fonction rénale postopératoire n'était pas différente entre les deux groupes, et
n'avait pas significativement variée par rapport à la période pré-opératoire.
Ainsi, aucune néphrotoxicité du fluor n'a été observée après administration
prolongée de sévoflurane aussi bien chez des patients à fonction rénale normale que
chez des patients insuffisants rénaux.
1.3.2. TOXICITE RENALE DU COMPOSE A
Chez le rat, le composé A est néphrotoxique de manière dose-dépendant
provoquant des lésions du tube contourné proximal. La concentration létale 50 chez
le rat est comprise entre 1050 et 1090 ppm après une heure d'exposition au
sévoflurane [9], et entre 330 et 420 ppm après trois heures [10]. Le seuil de
néphrotoxicité du composé A chez le rat est de 150 à 200 ppm après une heure
d'administration, et de 144 ppm après trois heures [11]. Malgré cette néphrotoxicité
théorique du sévoflurane chez l'animal, aucune publication n'a jusqu'à ce jour fait
état, chez l'homme, d'une altération de la fonction rénale, même après anesthésie
prolongée ou utilisation de circuit fermé (concentration de composé A proche de
32 ppm dans la branche inspiratoire) [12]. La raison précise de l'absence de
néphrotoxicité du composé A chez l'homme n'a pas été définitivement établie bien
qu'elle puisse être due à une différence d'activité de la ß-lyase entre le rat et
l'homme. En effet, l'activité rénale de cet enzyme est 10 fois plus importante chez le
rat que chez l'homme [13].
Chez l'homme sans insuffisance rénale, la toxicité du composé A a été étudiée
lors d'une anesthésie au long cours (plus de 12 heures), en circuit semi fermé (débit
de gaz frais = 1l/min) : conditions expérimentales nécessaires à l'obtention d'une
concentration élevée du composé A. La concentration cumulée de sévoflurane était
supérieure à 13 CAM/h. La concentration du composé A, mesurée dans le circuit
d'anesthésie était plus élevée (24,6 ± 7,2 ppm, n = 50 ; m ± sd) que lors d'une
anesthésie comparable à l'isoflurane (0,66 ± 0,2 ppm, n = 50). En postopératoire, la
fonction rénale de ces patients n'était pas différente entre les deux groupes de
traitement [14].
A l'heure actuelle, aucune étude s'intéressant à la toxicité du composé A n'a été
réalisée chez l'insuffisant rénal. Il est donc logique, par mesure de prudence, soit
d'éviter l'utilisation du sévoflurane chez l'insuffisant rénal, soit, en cas d'utilisation
de cet agent, de ne pas descendre au-dessous de 2 litres de débit de gaz frais (afin de
limiter la production du composé A).
En résumé, chez des patients ayant une fonction rénale normale en pré-
opératoire, le sévoflurane administré au long cours, en circuit ouvert (avec une
concentration plasmatique de fluor supérieure au seuil toxique théorique de
50 µmol/l) ou en circuit fermé (participation du composé A) n'entraîne pas

Nouveaux médicaments
123
d'altération de la fonction rénale en postopératoire. Le sévoflurane peut donc être
administré au moyen d'un circuit avec réinhalation, sans crainte d'utiliser un débit de
gaz frais faible de l'ordre de 1 l/min. D'ailleurs, l'Agence Française du Médicament
n'a retenu aucune valeur seuil du débit de gaz frais pour l'administration du
sévoflurane.
2. ANESTHESIE AU SEVOFLURANE CHEZ L'ADULTE
2.1. INDUCTION AU MASQUE
Quelles sont les qualités requises pour qu'un agent anesthésique volatil puisse
être utilisé comme agent d'induction ? La réponse à cette question ne fait pas de
doute : effet anesthésique d'installation rapide et bonne tolérance respiratoire. Le
sévoflurane répond parfaitement à ce cahier des charges car, d'une part, il est
suffisamment peu soluble dans le sang (coefficient de partage sang/gaz = 0,68) pour
entraîner la perte de conscience en moins de 2 minutes, et d'autre part, il n'est pas
irritant pour les voies aériennes supérieures. Le sévoflurane est donc utilisable pour
l'induction au masque chez l'enfant et même chez l'adulte. A l'évidence, l'induction
au masque chez l'adulte ne se substitue pas à l'induction intraveineuse qui reste la
technique de référence. Cependant, il peut être très utile de disposer d'un tel agent en
cas d'allergie vraie aux agents intraveineux, d'abord vasculaire périphérique
difficile, ou en cas d'intubation difficile prévue.
Certaines recommandations de bon sens doivent être respectées afin de faciliter
cette induction au masque. L'information des patients est un élément capital,
information donnée la veille lors de la visite pré-anesthésique, et renouvelée juste
avant le début de la procédure. Afin de réduire le délai d'induction, l'application du
masque facial doit être la plus étanche possible évitant les fuites. La taille du
masque doit être adaptée à l'anatomie du patient. La mesure de la fraction télé-
expiratoire en oxygène permet la détection rapide de toute fuite et permet le
monitorage correct de la pré-oxygénation [15]. Une prémédication peut être
prescrite, mais l'utilisation de morphinomimétiques semble déconseillée du fait de la
dépression respiratoire qu'ils provoquent (la ventilation alvéolaire étant le
« moteur » de cette technique d'induction). Deux techniques peuvent être employées
: soit la technique dite de la capacité vitale (single breath induction des anglo-
saxons), soit la technique en ventilation normale. La technique de la capacité vitale
nécessite un entraînement préalable du patient. Après avoir saturé le circuit avec
8 % de sévoflurane, on demande au patient d'expirer jusqu'au volume résiduel, puis
d'inspirer profondément et de bloquer sa respiration aussi longtemps que possible.
L'autre technique requiert une moins grande coopération du patient. Il suffit de
laisser le patient ventilé spontanément à une fréquence respiratoire et à un volume
courant normal. La concentration de sévoflurane peut être augmentée graduellement
ou débutée d'emblée à 8% (la bonne tolérance respiratoire et hémodynamique du
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%