Exam mai 04 corrigé

Université Joseph Fourier Grenoble Licence 1ère année
2007-2008 CHI 120
CHIMIE INORGANIQUE - Examen de Mai 2004 (1h30)
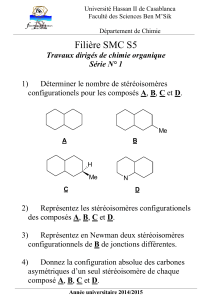
I – AZOTE a) Donner les formules des oxydes d’azote de degré d’oxydation II, III et V. Ecrire
pour chacun d’eux une réaction caractéristique acido-basique ou d’oxydoréduction (au choix).
b) Quel composé usuel l'azote forme-t-il avec l'hydrogène? Discuter ses propriétés acide-base au
sens de Lewis et de Bronsted. On écrira en particulier sa réaction de dissolution dans l’eau.
c) L'azote forme aussi avec l'hydrogène un composé de formule brute N2H4, appelé hydrazine.
Ecrire sa formule développée. Quel est le degré d’oxydation de l’azote dans ce composé ? Donner
un exemple de réaction où l’hydrazine se comporte comme réducteur.
II – OXYDES a) Donner les formules des oxydes qui conduisent par hydrolyse aux oxo-acides
suivants : HIO4, HIO
b) Quel est l’acide le plus fort ? Justifier votre réponse ?
III - OXYDES Classer la série d’oxydes suivante par ordre de caractère ionique croissant. Justifier
vos réponses par le plus d'arguments possible.
BeO, Cs2O, MnO, Na2O
En déduire les propriétés acido-basiques de tous ces oxydes par rapport à l'eau ; on écrira les
réactions avec l'eau en indiquant les espèces présentes à l'équilibre en solution.
Données d’électronégativité et de rayon ionique (en pm = 10-12 m, entre parenthèses) :
Be : 1,5 (34) Cs : 0,7 (165) Mn : 1,5 (91) Na : 0,9 (98) O : 3,5
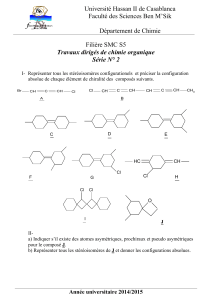
IV – COMPLEXES de COORDINATION
On donne les formules semi-développées des complexes de coordination suivants :
(1) : [NiBr2Cl2]2-, (2) : [Ni(en)2(NH3)2]2+ avec en = H2N-CH2-CH2-NH2
(3) : [FeCl4Br2]3-, (4) : [Fe(CN)6]4-
(a) Quel est le degré d'oxydation du métal dans chacun de ces complexes ?
(b) Sachant que le complexe (1) existe sous deux formes stéréoisomères, quelle est la géométrie de
ce complexe ? Justifier votre réponse. Représenter ces deux stéréoisomères.
(c) Dénombrer les différents stéréoisomères possibles de (2) et donner les représentations spatiales
de ces stéréoisomères. Par un dessin, montrer comment se fait la coordination entre l’ion métallique
et « en ».
(d) Donner la répartition des électrons d de l’ion métallique dans les complexes 3 et 4 en
représentant le diagramme d'énergie des orbitales d d'après le modèle du champ cristallin. En
déduire le nombre d’électrons non appariés dans chaque cas et la propriété magnétique qui en
découle. Fe : Z = 26. Cl- et Br- : ligands à champ faible, CN- : ligand à champ fort.
V – ALUMINIUM Décrire les 3 étapes principales de la préparation de l’oxyde d’aluminium
Al2O3 à partir d’un minerai de bauxite formé initialement d’un mélange d’oxydes d’aluminium, de
fer, de titane et de silicium. On écrira les réactions chimiques correspondant à chaque étape.
_______________________

CORRIGE - Examen de Mai 2004 (1h30)
I – AZOTE
a) Donner les formules des oxydes d’azote de degré d’oxydation II, III et V. Ecrire pour chacun
d’eux une réaction caractéristique acido-basique ou d’oxydoréduction (au choix).
II : NO NO + ½O2 NO2
III : N2O3 N
2O3 + H2O 2HNO2 2H+ + 2NO2-
V : N2O5 N
2O5 + H2O 2HNO3 2H+ + 2NO3-
b) Quel composé usuel l'azote forme-t-il avec l'hydrogène? Discuter ses propriétés acide-base au
sens de Lewis et de Bronsted. On écrira en particulier sa réaction de dissolution dans l’eau.
: NH3 Base de Lewis et de Bronsted
NH3 + H2O NH4 + OH-
Lewis : 4NH3 + Cu2+ [Cu (NH3)4]2+
c) L'azote forme aussi avec l'hydrogène un composé de formule brute N2H4, appelé hydrazine.
Ecrire sa formule développée. Quel est le degré d’oxydation de l’azote dans ce composé ? Donner
un exemple de réaction où l’hydrazine se comporte comme réducteur.
N
N
H
H
H
H
D
egré d'oxydation - II
N2H4 + O2 N
2 + 2H2O
II – OXYDES
a) Donner les formules des oxydes qui conduisent par hydrolyse aux oxo-acides suivants : HIO4,
HIO
HIO4 : I : +VII I2O7
HIO : I : +I I2O
b) Quel est l’acide le plus fort ? Justifiez votre réponse.
Degré d'oxydation acidité
HIO4 > HIO

III - OXYDES Classer la série d’oxydes suivante par ordre de caractère ionique croissant. Justifier
vos réponses par le plus d'arguments possible.
BeO, Cs2O, MnO, Na2O
En déduire les propriétés acido-basiques de tous ces oxydes par rapport à l'eau ; on écrira les
réactions avec l'eau en indiquant les espèces présentes à l'équilibre en solution.
• Différence d'éléctronégativité caractère ionique :
BeO, MnO < Na2O < Cs2O
• Le pouvoir polarisant P du cation varie comme (q/r2) et si P , le caractère ionique
or r (Be) < r(Mn) , donc P (Be) > P (Mn), d’où le classement :
BeO < MnO < Na2O < Cs2O
BeO + H2O Be(OH)2 Be2+ + 2OH-
MnO + H2O Mn(OH)2 Mn2+ + 2OH-
Na2O + H2O 2NaOH 2Na+ + 2OH-
Cs2O + H2O 2CsOH 2Cs+ + 2OH-
IV – COMPLEXES de COORDINATION
On donne les formules semi-développées des complexes de coordination suivants :
(1) : [NiBr2Cl2]2-, (2) : [Ni(en)2(NH3)2]2+ avec en = H2N-CH2-CH2-NH2
(3) : [FeCl4Br2]3-, (4) : [Fe(CN)6]4-
a) Quel est le degré d'oxydation du métal dans chacun de ces complexes ?
(1) x – 2 – 2 = - 2 x = + 2 Ni + II
(2) x + 0 + 0 = + 2 x = + 2 Ni + II
(3) x – 4 – 2 = - 3 x = + 3 Fe + III
(4) x – 6 = - 4 x = + 2 Fe + II
b) Sachant que le complexe (1) existe sous deux formes stéréoisomères, quelle est la géométrie de
ce complexe ? Justifier votre réponse. Représenter ces deux stéréoisomères.
La coordination 4 conduit à 2 géométries possibles : plan carré et tétraédrique. La géométrie plan
carré peut donner 2 stéréoisomères.
N
i
Br
Cl
Cl
Br
N
i
Br
Br
Cl
Cl
cis trans

c) Dénombrer les différents stéréoisomères possibles de (2) et donner les représentations spatiales
de ces stéréoisomères. Par un dessin, montrer comment se fait la coordination entre l’ion métallique
et « en ».
CH2 H2C
2
NH
••
2
HN
••
Ni
N
i
N
H3
N
H3
N
N
N
N
trans
N
i
N
N
H3
N
H3N
N
N
N
i
N
N
H3
N
N
N
N
H3
cis
2 énantiomères
(d) Donner la répartition des électrons d de l’ion métallique dans les complexes 3 et 4 en
représentant le diagramme d'énergie des orbitales d d'après le modèle du champ cristallin. En
déduire le nombre d’électrons non appariés dans chaque cas et la propriété magnétique qui en
découle.
Fe : Z = 26. Cl- et Br- : ligands à champ faible, CN- : ligand à champ fort.
Complexe 3
Fe Z = 26 …..3d6 4s2
Fe3+ …..3d5
faibleEΔ
5 e- non appariés
paramagnétique
Complexe 4
Fe2+ …..3d6
E
élevé
Δ
0 e- non apparié
diamagnétique

V – ALUMINIUM Décrire les 3 étapes principales de la préparation de l’oxyde d’aluminium
Al2O3 à partir d’un minerai de bauxite formé initialement d’un mélange d’oxydes d’aluminium, de
fer, de titane et de silicium. Ecrire les réactions chimiques correspondant à chaque étape.
• Solubilité Al2O3 en milieu basique
(précipitation des hydroxydes de fer, de titane et de silicates)
Al2O3 + 2(Na+,OH-) + 3H2O 2Al(OH)4-) + 2Na+
• Précipitation Al(OH)3
2(Na+, Al(OH)4-) + 2H+ 2Al(OH)3 + 2Na+ + 2H2O
• Déshydratation de Al(OH)3 par calcination
2 Al(OH)3 1200°C Al2O3 + 3H2O
____________________
1
/
5
100%