géochimie des eaux de sources et interaction eau

QUANTERRA SHORT COURSE – 08F 28.03.2004
QUANTERRA
INTERNATIONAL INDEPENDENT CENTER OF CLIMATE CHANGE IMPACT ON NATURAL RISK
ANALYSIS IN MOUNTAINOUS AREA Short course
GÉOCHIMIE DES EAUX
DE SOURCES ET
INTERACTION EAU-
ROCHE DANS LES
ALPES
Résume du cours donné dans le cadre du module "Altération et minéralogie industrielle" du Dr. Ph.
Thélin, avril 2000, pour les étudiants de géologie des universités de Lausanne et Genève.
P
Pa
ar
r
M
Ma
ar
rc
c-
-H
He
en
nr
ri
i
D
De
er
rr
ro
on
n
C
Ce
en
nt
tr
re
e
d
d'
'A
An
na
al
ly
ys
se
e
M
Mi
in
né
ér
ra
al
le
e,
,
S
Sc
ci
ie
en
nc
ce
es
s
d
de
e
l
la
a
T
Te
er
rr
re
e,
,
U
UN
NI
I
L
La
au
us
sa
an
nn
ne
e
A
Ad
dr
re
es
ss
se
e
a
ac
ct
tu
ue
el
ll
le
e:
:
S
Se
er
rv
vi
ic
ce
e
G
Ge
eo
ol
lo
og
gi
iq
qu
ue
e
d
de
e
N
No
or
rv
vè
èg
ge
e
N
No
or
rg
ge
es
s
g
ge
eo
ol
lo
og
gi
is
sk
ke
e
u
un
nd
de
er
rs
sø
øk
ke
el
ls
se
e
(
(N
NG
GU
U)
)
L
Le
ei
iv
v
E
Ei
ir
ri
ik
ks
ss
so
on
ns
s
v
ve
ei
i
3
39
9,
,
N
NO
O-
-T
Tr
ro
on
nd
dh
he
ei
im
m
7
74
49
91
1
m
ma
ar
rc
cd
de
er
rr
ro
on
n@
@y
ya
ah
ho
oo
o.
.c
co
o.
.u
uk
k
A
Av
ve
ec
c
l
la
a
c
co
ol
ll
la
ab
bo
or
ra
at
ti
io
on
n
d
du
u
p
pr
ro
of
fe
es
ss
se
eu
ur
r
H
Ha
an
ns
s-
-R
Ru
ue
ed
di
i
P
Pf
fe
ei
if
fe
er
r
C
Ce
en
nt
tr
re
e
d
d'
'A
An
na
al
ly
ys
se
e
M
Mi
in
né
ér
ra
al
le
e,
,
S
Sc
ci
ie
en
nc
ce
es
s
d
de
e
l
la
a
T
Te
er
rr
re
e,
,
U
UN
NI
I
L
La
au
us
sa
an
nn
ne
e
h
ht
tt
tp
p:
:/
//
/w
ww
ww
w-
-s
ss
st
t.
.u
un
ni
il
l.
.c
ch
h/
/c
ca
am
m/
/
w
w
ww
w
ww
w
w.
.
.q
q
qu
u
ua
a
an
n
nt
t
te
e
er
r
rr
r
ra
a
a.
.
.o
o
or
r
rg
g
g
Quanterra
Chemin de la Tour-Grise 28
1007-Lausanne
Tel. + 41 79 752 35 15
E-mail: [email protected]

GÉOCHIMIE DES EAUX DE SOURCES ET INTERACTION EAU-ROCHE DANS LES ALPES
1. INTRODUCTION
Les études d'interactions fluide-roche ont pour but de décrire, quantifier et prédire les changements
de compositions chimiques et minéralogiques des phases solide et liquides dans des systèmes
naturels au cours du temps. Ces études ont pris une importance croissante durant ces dernières
années, tant du point de vue de la compréhension théorique des systèmes naturels, que par les
applications très concrètes qui en résultent. Les grandes directions de ces développements sont
l'exploitation des ressources énergétiques et des matières premières de la croûte terrestre, ainsi que
les aspects liés à la qualité des milieux naturels. Par exemple:
- l'exploitation des ressources géothermiques de basse et haute enthalpie, les réservoirs de
type "hot dry rock".
- le stockage et l'exploitation des hydrocarbures.
- les études des gisements métallifères et des fluides minéralisateurs, l'extraction des métaux
(ou du sel, depuis déjà fort longtemps) par des fluides.
- les polluants organiques et inorganiques des aquifères (mobilité, dégradation,...).
- le stockage des déchets spéciaux et radioactifs.
- l'acidification des bassins versants (pluies acides) et l'impact sur l'environnement de produits
anthropogènes (mobilité du plomb).
- l'étude des processus erosifs et leur quantification.
- l'assainissement d'eaux naturellement toxiques: les eaux acides des roches sulfurées ou les
empoisonnements causés par l'arsenic des aquifères du Bangladesh et d'autres régions
d'Asie.
2. INTERACTION EAU-ROCHE DANS LES ALPES
Le but de cette étude est de mettre en évidence les façons dont les roches alpines influencent la
composition chimique des eaux naturelles. Afin de caractériser la composition chimique des eaux
en fonction des lithologies qui constituent le substratum, on étudie les eaux de sources de petits
bassins versants monolithologiques alpins: Basabé (1992) pour les flysch, Dematteis (1995) pour
les calcaires, Derron (1999) pour les roches mafiques, Dubois (1992) pour les granites, Hesske
(1995) pour la molasse, Mandia (1991) pour les évaporites triasiques et Pfeifer (1977) pour les
roches ultramafiques (Tables 1 et 2).
Il paraît évident qu'une eau qui a circulé à travers des lithologies triasiques de gypse ou d'anhydrite
soit fortement enrichie en sulfate (par exemple les eaux d'Aproz). Mais ce simple raisonnement
n'est souvent pas applicable, et en particulier aux éléments traces. Deux exemples permettent
d'illustrer ceci:
1) il y a 10 à 100 fois plus de rubidium dans les roches granitiques que dans les gypses. Mais les
eaux qui ont circulé à travers les granites ne contiennent que ~ 1 µg/l de Rb, alors que celles qui
sortent des gypses en contiennent 10 à 30 µg/l.
2) la teneur en Ni des roches ultramafiques est d'environ 2000 ppm, celle des granites de ~15
ppm. De plus, les minéraux composants les roches ultramafiques sont plus facilement mis en
solution que les minéraux des granites. Pourtant, on trouve les mêmes concentrations en nickel
dans les eaux qui ont traversé l'une ou l'autre de ces lithologies (1-7 µg/l) !

Géochimie des eaux de sources et interaction eau-roche dans les Alpes
3
Table 1: compositions chimiques représentatives des principales lithologies alpines. Analyses de
Faure (1992) , Mandia (1991) pour les gypses dolomitiques.
Minéralogie simplifiée des roches considérées:
- granito-gneiss: quartz, plagioclase(s), K-feldspath, mica(s)
- métabasaltes: amphibole, albite, Mg-chlorite, (épidote, sphène)
- roches ultrabasiques: serpentine, olivine, diospside, brucite, magnésite, talc
- calcaires: calcite, Mg-calcite, quartz
- gypses dolomitiques: calcite, dolomite, gypse, anhydrite, epsomite
En essayant de mieux comprendre ces quelques observations, plusieurs questions se posent:
1) quel est l'importance, dans l'interaction eau-roche, de la composition minéralogique d'une roche
par rapport à sa composition chimique? 2) quels sont les processus chimiques qui régulent les
concentrations des éléments en solution dans les eaux naturelles ?
Roches silicatées
Roches Carbonatées
Element (ppm)
Granite
Basalte
Peridotite
Calcaire
Dol + Gypse
Li 24 16 0.5 5 -
B9 5 2 20 -
F520 385 100 330 -
Na wt % 2.84 1.87 0.49 0.04 0.29
Mg wt % 0.94 4.55 23.2 4.7 4.7
Al wt % 8.2 8.28 1.2 0.42 0.24
Si wt % 31.4 23.5 19.8 2.4 0.56
P920 1130 195 400 349
S300 300 200 1200 9
Cl 130 55 45 150 -
K wt % 2.52 0.83 0.017 0.27 0.15
Ca wt % 2.53 7.2 1.6 30.23 32.1
Ti 3400 11400 300 400 119
V88 225 40 20 -
Cr 22 185 1800 11 -
Mn 540 1750 1560 1100 288
Fe wt % 2.96 8.6 9.64 0.33 0.26
Co 7 47 175 0.1 33
Ni 15 145 2000 20 10
Cu 30 94 15 4 5
Zn 60 118 40 20 48
As 1.9 2.2 0.8 1 -
Rb 110 38 1.1 3 6
Sr 440 452 5.5 610 2880
Y35 21 0 30 18
Zr 140 120 38 19 19
Nb 20 20 9 0.3 4
Mo 11.5 0.3 0.4 -
Ag 0.051 0.11 0.05 0.01 -
Cd 0.13 0.21 0.05 0.035 -
Ba 420 315 0.7 10 14
Hg 0.08 0.09 0.01 0.04 -
Pb 15 7 0.5 9 2
Th 8.5 3.5 0.0045 1.7 1
U30.75 0.002 2.2 -

Géochimie des eaux de sources et interaction eau-roche dans les Alpes
4
3. EAUX DE SOURCES ALPINES - GÉNÉRALITÉS
Les eaux dont il est question ici sont des eaux peu profondes (sub-surface). Les eaux profondes,
comme celles échantillonnées dans des forages ou dans certaines galeries, présentent fréquemment
des caractéristiques chimiques très différentes des eaux de (sub-) surface.
Ces eaux superficielles sont froides (T < 12 °C), généralement neutres à basiques (pH = 7 - 9), et
à l'équilibre avec la pression d' O2 atmosphérique (oxydantes)
La Table 2 présente les concentrations médianes en éléments majeurs et traces des eaux de sources
alpines pour les 5 lithologies considérées:
Table 2: concentrations médianes en éléments traces et majeurs des eaux de sources alpines
(Derron 1999).
élément granito-gneiss r. mafiques r. ultramafiques calcaires gypse dolom.
Al µg/l 32.1 8.4 5.8 1.7 17.1
As µg/l 6.9 2.4 0.2 0.6
Bµg/l 20.0 5.1 8.5 30
Ba µg/l 2.1 0.7 4.3 17.0 9.7
Br µg/l 2.9 8.2
Ca mg/l 12.0 23.3 8.3 62.0 444.5
Cd µg/l <0.1 0.1 0.3
Cl mg/l 0.4 1.3 2.1 2.6 3.6
Co µg/l 0.3 0.3 0.1 0.2
Cr µg/l 1.4 1.5 0.3 0.4
Cu µg/l 4.8 2.5 1.1 0.4 3.1
Fmg/l 0.20 0.10 0.07 0.05 0.09
Fe µg/l 32.3 15.0 6.3 30
HCO3 mg/l 32 61 73 198 232
Kmg/l 1.2 0.7 0.7 0.6 1.5
Iµg/l 36.3 6.2
Li µg/l 4.0 1.0 1.8 30
Mg mg/l 0.6 3.3 9.4 4.1 56.9
Mn µg/l 1.1 0.6 0.4 0.7 13.1
Mo µg/l 3.9 0.3
Na mg/l 1.8 1.1 3.0 1.3 5.0
Ni µg/l 0.3 3.3 2.1 0.7 3.1
NO3 mg/l 1.0 1.2 3.8 2.7 1.9
Pb µg/l 0.2 0.1 0.4
Rb µg/l 1.0 0.6 0.7 17.4
Sc µg/l 5.6 30 0.2 2.8
Si mg/l 3.0 2.7 6.1 2.2 3.0
Sr µg/l 60 100 20 300 8320
SO4 mg/l 9.6 15.7 8.1 9.7 1110
Ti µg/l 3.3 2.3 0.3
Uµg/l 6.1 0.3 6.35
Vµg/l 0.7 0.4 0.3 0.4
Zn µg/l 5.2 4.3 3.6 1.2 2.7

Géochimie des eaux de sources et interaction eau-roche dans les Alpes
5
4. ÉLÉMENTS MAJEURS
Les éléments majeurs d'une eau naturelle sont les cations Ca2+, Na+, Mg2+, K+ et les anions HCO3-,
SO42-, Cl-, NO3-, (et éventuellement Si). Ce sont les éléments indiqués classiquement sur les
bouteilles d'eaux minérales. Un paramètre physico-chimique mesuré sur le terrain systématiquement
pour les eaux de surface est la conductivité électrique (en µS/cm). Les sources alpines ont des
conductivités électriques entre 10 et 3000 µS/cm (Figure 1). Les conductivités des eaux associées
aux roches silicatées sont les moins élevées, jusqu'à 300 µS/cm. Les eaux des roches carbonatées
ont des conductivités de 100 à 1000 µS/cm. Les roches contenant des sulfates (gypses, anhydrite,
epsomite) augmentent considérablement la conductivité lorsqu'elles sont dissoutes: 1000 - 3000
µS/cm. La conductivité et la somme des anions (Figure 1) indique que les minéraux sulfatés sont les
plus facilement mis en solution, puis les carbonates et enfin les silicates.
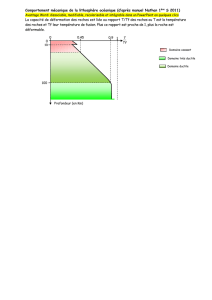
Figure 1: somme des principaux anions (HCO3- et SO42-) en fonction de la conductivité électrique,
dans les eaux de sources alpines (Derron 1999).
Le diagramme de Piper est une des façons les plus classiques de comparer les compositions
chimiques, en éléments majeurs, d'un grand nombre d'eaux (Figure 2). Pour des raisons de lisibilité,
les eaux des roches silicatées et carbonatées sont présentées dans deux figures distinctes.
Les faciès hydrochimiques, d'après Jaeckli (1970), sont aussi fréquemment utilisés en
hydrogéologie pour décrire grossièrement la composition d'eaux naturelles. Le principe est le
suivant: 1) ne sont considérées que les concentrations relatives (en % de meq/l), des cations et
anions, supérieures à 10% ; 2) les cations sont indiqués en premier, par ordre décroissant
d'abondance, puis les anions de la même manière; 3) les teneurs supérieures à 50% sont soulignées
et celles entre 10 et 20% sont mises entre parenthèses.
conductivité électrique [S/cm]
µ
HCO + SO [mg/l]
3
- --
4
granito-gneiss
roches mafiques
roches ultramafiques
calcaires
gypse dolomitique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%