AIC-2011-03-14_radium

Page 1 sur 3
UdPPC – AIC-2011 - dossier n°11a - Présentation 14/03/2011
L’élément Radium
Ra (Z = 88)
Par Robert Guillaumont
Un élément historique …tombé en désuétude
Découverte
Le 226Ra (période de 1600 ans) a été découvert dans la pechblende de Joachimisthal par Pierre et
Marie Curie en 1898 et isolé de cette source en jouant sur les faibles différences de propriétés
chimiques entre Ra et Ba. C’est l’homologue supérieur du Ba. 226Ra appartient à la famille
radioactive naturelle générée par 238U. Dans les minerais d’uranium il existe aussi 223Ra (période
11,3 jours) qui appartient à la famille de 235U.
Les isotopes
Dans la famille de 232Th on trouve 228Ra (5,7 ans) et 224Ra (3,64 jours). C’est à partir de ces 4
radionucléides qui étaient en 1910 bien identifiés par leurs caractéristiques nucléaires (période
et énergie des rayonnements alpha) et qui avaient tous les mêmes propriétés chimiques qu’est
née la notion d’isotopie. Aujourd’hui on connaît 34 isotopes de Ra (201< A< 234). Ceux qui
n’existent pas dans la nature peuvent être préparés par réactions nucléaires avec des ions
accélérés mais les plus riches ou les plus déficients en neutrons n’ont aucun intérêt pratique.
Parmi eux 225Ra, émetteur bêta moins (14,9 jours) appartient à la famille radioactive artificielle
recrée de 237Np.
Les isotopes à vie longue ont été extraits des minerais de U (0,337g de 226Ra /tonne de U) et de
Th (0,4 mg de 228Ra /tonne de Th) et des résidus de l’extraction de U et de Th.
Industrie
L’industrie du radium a duré de 1904 jusque vers 1950 et environ 1 kg de 226Ra a été extrait dans
le monde pendant cette période. Les procédés chimiques étaient fondés sur la séparation Ba/Ra
par cristallisation fractionnée de divers sels mixtes, mais surtout des chlorures et bromures. Le
226Ra préparé au siècle précédent existe toujours.
Degré d’oxydation
Les propriétés physicochimique de Ra sont celles des alcalino-terreux et sont proches de celle de
Ba car, en raison de la contraction lanthanidique due au remplissage de la sous couche 4f à partir
de La, le rayon de l'ion Ra2+ (0,139 nm) diffère très peu de celui de l'ion Ba2+ (0,133 nm). Le Ra ne
présente qu’un seul degré d’oxydation : 2+. Sa chimie n’est pas très riche.
Obtention
Marie Curie et André Debierne ont préparé 80 mg de métal en 1910. Pour cela ils ont distillé sous
pression réduite dans une atmosphère d'hydrogène un amalgame Ra/Hg obtenu par électrolyse à
- 1,6 V. Le métal est aussi obtenu par décomposition thermique sous vide du nitrure Ra3N2, entre
180 et 250 0C ou par réduction sous vide poussé d'oxyde RaO par Al.
Propriétés
C’est un métal blanc brillant (cubique centré) qui noircit en présence d’air (nitrure) et fond vers
700 0C. Il forme des alliages par exemple avec Ag.
Le Ra métal est très réducteur [E0(Ra2+/Ra) = - 2,92 V, calculé), il réduit violemment H2O.
Les sels de radium sont isomorphes des sels correspondants du baryum. De blancs ils deviennent

Page 2 sur 3
UdPPC – AIC-2011 - dossier n°11a - Présentation 14/03/2011
jaunes ou violacés sous l'action de leur propre rayonnement (radiolyse) et tous sont luminescents.
Chlorure, bromure, nitrate, sulfure (les plus connus) sont solubles dans l'eau, comme l’hydroxyde,
sulfate, carbonate, chromate, iodates sont insolubles. Ces différences ont été mises à profit
dans les cristallisations fractionnées historiques.
En solution, le Radium est toujours à l’état d’ions Ra2+. Il ne forme des complexes qu’avec
quelques polyacides organiques (acide citrique, tartrique) ou l’EDTA.
Radioactivité
Les descendants de 226Ra plus ou moins rapidement en équilibre font qu’une source de Ra émet
plusieurs rayonnements et par ailleurs du 222Rn peut s’en dégager si elle n’est pas scellée,
transportant ainsi de la radioactivité et donnant les dépôts actifs à vie courte et à vie longue.
Historiquement l’unité d’activité, le Curie, a été définie comme l’activité du Rn en équilibre avec
1 gramme de 226Ra puis par la suite comme étant simplement égale à 3,7 1010 Bq. L’activité
spécifique de 226Ra est de 1 Ci/g. Le dosage absolu de 226Ra était fait par la mesure de l’activité
de 222Rn en équilibre avec 226Ra contenu dans l’échantillon, pourvu qu’il puisse être fondu ou mis en
solution pour que le Rn se dégage. Les étalons de 226Ra (et les échantillons commerciaux de Ra)
plus d’un mois après leur préparation étaient comparés entre eux par la mesure du rayonnement
gamma du 214Bi, (énergie gamma la plus élevée). C’est le prix exorbitant de 226Ra (200 000 fois
plus cher que l’or à certaines époques) qui a été la cause du développement d’une métrologie
précise de 226Ra et de la radioactivité. Aujourd’hui les isotopes de Ra sont couramment mesurés
par spectrométrie gamma.
Environnement
L’extraction massive de l’uranium pour alimenter l’énergie nucléaire de fission laisse des
centaines de millions de tonnes de résidus miniers contenant du Ra (5 à 30 Bq/g en moyenne mais
valeurs très variables) et l’uranium non extrait. Les résidus sont stockés dans ou sur les
anciennes mines sous couvertures d’argile pour limiter l’exhalaison du Rn. Les quantités de 226Ra
sur un site où sont stockées quelques millions de tonnes de résidus sont importantes. Les eaux
d’exhaure sont souvent chargées en 226Ra (et U) et elles sont traitées avant rejet à
l’environnement, qui est lui même surveillé. C’est pour cela que les bilans en 226Ra (et U) dans les
différents compartiments de l’environnement, que la migration de ces éléments et leur
accumulations éventuelles sont suivies. L’industrie du Ra a laissé des sites industriels pollués dont
on s’occupe encore. L’industrie des terres rares laisse des déchets contenant 226Ra (déchets dits
radifères, 1 kBq/g ou plus mais valeurs très variables). Ils sont entreposés pour l’instant.
Toxicité
L’exposition à une source de 1 mg de 226Ra à 10 cm délivre un débit de dose gamma de 0,8
milliSievert/h et de 0,8 10-2 milliSievert/h à 1 mètre. Dans l'organisme, le radium véhiculé par le
sang se fixe comme le calcium principalement sur la moelle osseuse, dans le squelette et les
dents. Il peut rester longtemps dans les poumons. Sa période biologique est d’environ 2,5 ans
pour l’organisme entier et de 5,5 ans pour les os. Les facteurs de dose par ingestion et inhalation
sont de 0,28 et de 9,5 microSievert/Bq.
Utilisations
De nombreuses utilisations du radium ont été développées au début et au long du 20 ème siècle,
surtout pour profiter de ses vertus médicales supposées (cosmétiques, dérivés alimentaires) ou
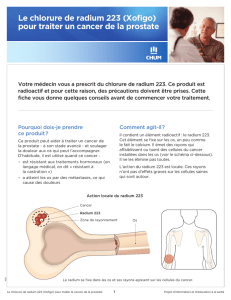
avérées (certains cancers). En curiethérapie (sources scellées intracavitaires sous forme
d’aiguilles pour délivrer une dose de proximité à quelques centimètres) c’est le rayonnement
gamma de un à plusieurs dizaines de mg de 226Ra qui était mis à profit. 226Ra a été utilisé en

Page 3 sur 3
UdPPC – AIC-2011 - dossier n°11a - Présentation 14/03/2011
gammagraphie jusqu’en 1935 et dans les paratonnerre dès 1932 (50 000 exemplaires en France).
Environ 120 g ont été utilisés en France dont 50 g pour le médical. Son irradiation en réacteur a
permis de synthétiser jusqu’à des grammes de 227Ac (émetteur alpha de 22 ans de période)
utilisé comme générateur thermoélectrique dans les satellites (séquence : 226Ra (n, gamma) 227Ra,
bêta moins, 227Ac). Le radium n’est plus utilisé.
1
/
3
100%