Chimie de laboratoire et des procedes industriels

1
CONCOURS GENERAL DES LYCEES
______
SESSION DE 2003
______
CHIMIE DE LABORATOIRE ET DES PROCEDES INDUSTRIELS
(Classes de Terminales CLPI)
DEUXIEME PARTIE
Durée : 6 heures
______
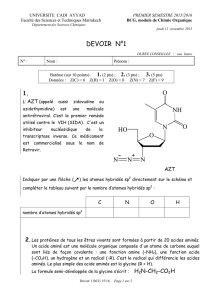
AUTOUR DE LA GLYCINE
La glycine (acide 2-aminoéthanoïque ou glycocolle) est un acide aminé. Elle participe à la
formation de molécules biologiques complexes, renouvelées en permanence, les protéines qui
constituent nos muscles, notre peau, nos cheveux, les parois de nos organes, nos os.... Chaque
protéine est caractérisée par le nombre d’acides aminés qui la composent et par l'enchaînement très
précis de ces derniers, reliés les uns aux autres par des liaisons peptidiques.
La glycine participe à la formation du glutathion dans l’organisme. Le glutathion a un rôle
antioxydant, il participe directement à la neutralisation des radicaux libres et maintient les
antioxydants exogènes comme la vitamine C et E dans leur état réduit, forme sous laquelle ils sont
actifs. La glycine est aussi un agent détoxifiant, il réagit ainsi dans l’organisme avec l’acide
benzoïque provenant du toluène (molécule très présente dans notre environnement industriel) pour
former l’acide hippurique, éliminé par l’urine. Ainsi, on dose l’acide hippurique chez les
travailleurs afin d’évaluer leur taux d'exposition au toluène par exemple.
En pharmacopée, la glycine intervient dans la synthèse d'une molécule qui fascine, la
créatine qui permet de prendre du muscle.
PARTIE A : CHIMIE ORGANIQUE
Synthèse de l'acide hippurique par acylation de la glycine
PARTIE B : CHIMIE INORGANIQUE
Dosage d'une solution de chlorhydrate de glycine et d'une solution de glycine
______
Pour une meilleure gestion du temps, il est conseillé de débuter la synthèse dès le début de
l'épreuve.
Si au cours de l’épreuve un candidat relève ce qui lui semble être une erreur d’énoncé, il le signale
dans sa copie et poursuit sa composition en indiquant les raisons des initiatives qu’il est amené à
prendre.

2
PARTIE A
CHIMIE ORGANIQUE
Synthèse de l'acide hippurique
Le métabolisme d’élimination des noyaux benzéniques, dans l’organisme, conduit à synthétiser de l’acide
benzoïque. Ce dernier est éliminé dans l'urine après conjugaison avec un acide aminé : la glycine, pour
former l’acide hippurique ou N-benzoylglycine. Cet acide est présent, en grande quantité dans l'urine des
herbivores (son nom vient de l'urine de cheval), et en petite quantité dans l'urine humaine.
Le processus enzymatique d’élimination consiste à condenser l’acide benzoïque avec la glycine par
acylation.
On se propose de réaliser, au laboratoire, la synthèse de l’acide hippurique par acylation de la glycine à l'aide
de chlorure de benzoyle.
1. Données
1.1. Matières premières :
• Glycine : 5 g
• Chlorure de benzoyle : 9 mL
• Solution d'hydrogénocarbonate de sodium à 10 % : 150 mL
• Ether diéthylique : 10 mL
• Solution d'acide chlorhydrique dilué au ½
• Eluants pour C.C.M. :
- éthanoate d'éthyle
- mélange eau/acide éthanoïque/butan-1-ol.
1.2. Données physico-chimiques et toxicologiques :
Produit
Masse
molaire
en
g.mol-1
TEB (sous
760
mmHg)
en °C.
Densité
(à
2O°C)
TFUS
en
°C. Autre Solubilité Critères toxicologiques
Glycine 75,07 - - 262 -
Peu soluble dans
l’eau.
Soluble dans
solution aqueuse
basique.
Acide benzoïque 122,12 - - 122-
123 -
Soluble à froid
dans l’éther
diéthylique.
Très peu soluble à
froid dans l’eau R : 22-36
S : 24
Chlorure de
benzoyle 140,57 197,2 1,212 -1,0 -
R : 40
S : (2-)23-24/25-36/37

3
Produit
Masse
molaire
en
g.mol-1
TEB (sous
760
mmHg)
en °C.
Densité
(à
2O°C)
TFUS
en
°C. Autre Solubilité Critères toxicologiques
Solution
d’hydrogénocarbo
nate de sodium - - - - - -
Dichlorométhane 84,90 40,1 1,300 -
95,1 -Solubilité dans
l'eau à 20°C : 1,3
g/100 mL R : 40
S : (2-)23-24/25-36/37
Esther diéthylique 74,1 34,6 - - Point
éclair :
-40 °C -
R : 12-19-22-66-67
S : 2-9-16-29-33
Solution d’acide
chlorhydrique
dilué au ½ - - - - - - R : 23-35
S :1/2-9-26-36/37/39-
45
Acide hippurique 179,18 -
Peu soluble à
froid dans l’eau,
soluble à chaud.
Très peu soluble
dans l’éther
diéthylique
Ninhydrine Point
éclair : -
4°C-
La substance est irritante
pour les yeux, la peau et
les voies respiratoires
Butan-1-ol
R : 10-20
S : 2-16
Ethanoate d’éthyle
R : 11
S : 2-16-23-29-33
Acide acétique
R : 10-35
S : 1/2-23-26-45

4
2. Mode opératoire
2.1. Synthèse
- Dans un ballon bicol de 250 mL, dissoudre 5 g de glycine dans 150 mL de solution
d'hydrogénocarbonate de sodium à 10 %.
- Adapter un réfrigérant ascendant surmonté d'un piège à vapeurs acides, une ampoule de coulée et
un système d'agitation magnétique.
- Ajouter, goutte à goutte, 9 mL de chlorure de benzoyle, tout en agitant vigoureusement. Une légère
effervescence apparaît.
- Agiter à température ambiante pendant 1 heure.
2.2. Séparation
- Verser le milieu réactionnel dans un bécher de 400 mL placé dans un bain de glace et équipé d’un
système d’agitation magnétique.
- Acidifier le milieu à l’aide d’acide chlorhydrique dilué jusqu’à obtenir une solution de pH de
valeur voisine de 1 ; des cristaux blancs apparaissent.
- Filtrer sur Büchner.
- Laver les cristaux avec deux volumes égaux à 5 mL d’éther diéthylique froid.
- Essorer, sécher et peser le produit brut. Soit m la masse totale de produit brut humide obtenu.
- Peser une masse m1 = 2 g de produit brut humide et la faire sécher à l’étuve pendant les
manipulations suivantes. Soit m’1 la masse de cet échantillon brut sec.
2.3. Purification
- Recristalliser le restant de produit brut humide dans l’eau. Soit m2 cette masse.
- Soit m’2 la masse de produit pur sec correspondant.
2.4. Identification et pureté
- Température de fusion : Prendre le point de fusion du produit pur sec.
- Chromatographie :
On réalisera deux chromatographies.
Première chromatographie :
La première chromatographie est une chromatographie sur couche mince de gel de silice
sensible aux rayonnements U.V. La phase mobile est constituée d'éthanoate d'éthyle.
• Préparer les échantillons de produit pur sec, de produit brut sec, d’acide benzoïque et d’acide
hippurique commercial par dilution dans du dichlorométhane.
• Déposer les échantillons.
• Procéder à l’élution.
• Sécher le chromatogramme au sèche-cheveux.
• Exploiter le chromatogramme C.C.M.1 sous rayonnement U.V. (λ = 254 nm).
Deuxième chromatographie :
La deuxième plaque est une chromatographie sur couche mince de gel de silice non sensible aux
U.V. La phase mobile est constituée d'un mélange d’eau (2V)/acide éthanoïque (2V)/butan-1-ol
(4V).
• Préparer les échantillons de produit pur sec, de produit brut sec et de glycine par dilution
dans du dichlorométhane.
• Déposer les échantillons.
• Procéder à l’élution.
• Sécher le chromatogramme au sèche-cheveux.
• Révéler par pulvérisation d’une solution de ninhydrine à 0,2 % (travailler sous hotte et avec
des gants, mettre à l’étuve à 100 °C durant 5 min).
• Exploiter le chromatogramme C.C.M.2.

5
3. Questions
3.1. Synthèse, séparation et purification
3.1.1. Écrire l'équation de dissolution de la glycine dans la solution d'hydrogénocarbonate de sodium.
3.1.2. Écrire l'équation de réaction entre le chlorure de benzoyle et la glycine en solution.
3.1.3. Quel est le rôle de l'acide chlorhydrique? Écrire l'équation de la réaction correspondant à son
introduction dans le mélange après réaction.
3.1.4. Quelle réaction parasite faisant intervenir le chlorure de benzoyle peut avoir lieu ?
3.1.5. Que contiennent les cristaux blancs ?
3.1.6. Quel est le rôle du lavage à l'éther diéthylique ?
3.1.7. Écrire l'équation chimique qui traduit l'acylation mise en œuvre ici.
3.1.8. Calculer les quantités de matières des espèces utilisées. En déduire le réactif limitant.
3.2. Identification et pureté
3.2.1. Rappeler le principe de la chromatographie sur couche mince.
3.2.2. Pourquoi est-il possible de révéler la C.C.M.1 aux rayonnements U.V. ?
3.2.3. Remplir la feuille de résultats fournie en annexe 1.
3.2.4. On donne les spectres I.R. de la glycine et de l’acide hippurique en annexe 2.
3.2.5. Identifier celui qui correspond à l’acide hippurique. Justifier votre réponse.
3.2.6. En vous aidant du document reproduit en annexe 2, interpréter le spectre de la glycine.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%