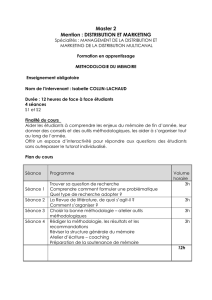
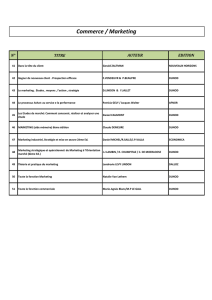
Mc MURRY

Table des matières
Chimie organique
Les grands principes 2
e
édition – Dunod – 2007
John Mc Murry
Eric Simanek
CHAPITRE 1 •
STRUCTURE ET LIAISON ACIDES ET BASES
CHAPITRE 2 •
LA NATURE DES COMPOSÉS ORGANIQUES
CHAPITRE 3 •
LA NATURE DES RÉACTIONS EN CHIMIE ORGANIQUE : ALCÈNES
CHAPITRE 4 •
RÉACTIVITÉ DES ALCÈNES ET DES ALCYNES
CHAPITRE 5 •
COMPOSÉS AROMATIQUES
CHAPITRE 6 •
STÉRÉOCHIMIE
CHAPITRE 7 •
HALOGÉNOALCANES
CHAPITRE 8 •
ALCOOLS, PHÉNOLS ET ÉTHERS-OXYDES
CHAPITRE 9 •
ALDÉHYDES ET CÉTONES : RÉACTIONS D’ADDITION NUCLÉOPHILE
CHAPITRE 10 •
ACIDES CARBOXYLIQUES ET DÉRIVÉS
CHAPITRE 11 •
RÉACTIONS DE SUBSTITUTION EN αα
αα
D’UN CARBONYLE ET RÉACTIONS DE CONDENSATION
© DUNOD 2008 - Chimie organique : Les grands principes - John McMurry et Eric Simanek

II
Table des matières
CHAPITRE 12 •
AMINES
CHAPITRE 13 •
DÉTERMINATION DES STRUCTURES
CHAPITRE 14 •
BIOMOLÉCULES : GLUCIDES
CHAPITRE 15 •
MOLÉCULES BIOLOGIQUES : ACIDES AMINÉS, PEPTIDES ET PROTÉINES
CHAPITRE 16 •
BIOMOLÉCULES : LIPIDES ET ACIDES NUCLÉIQUES
CHAPITRE 17 •
LA CHIMIE ORGANIQUE DES PROCESSUS MÉTABOLIQUES
© DUNOD 2008 - Chimie organique : Les grands principes - John McMurry et Eric Simanek

C
hapitre
1
Structure et liaison
Acides et bases
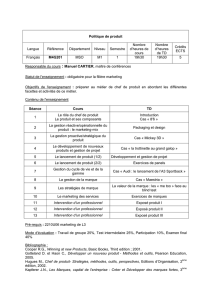
SOLUTIONS DES EXERCICES SUPPLÉMENTAIRES (SÉLECTION)
Configuration électronique
➤
1.30
Le tableau de la classification périodique des éléments est construit et organisé en groupes (IA,II A, IV B…)
selon le nombre d’électrons sur sa couche externe
a) Oxygène (groupe VIA) = 6 électrons sur sa couche externe
b) Magnésium (groupe IIA) = 2 électrons sur sa couche externe
c) Fluor (groupe VIIA) = 7 électrons sur sa couche externe
Structure de Lewis
➤
1.32
La formule correcte des molécules :
a) AlCl
3
b) CF
2
CL
2
c) NI
3
➤
1.34
Formules développées
➤
1.36
➤
1.38
Les molécules suivantes ont comme structure développée :
© DUNOD 2008 - Chimie organique : Les grands principes - John McMurry et Eric Simanek

2 1
•
Structure et liaison Acides et bases
➤
1.40
Electronégativité
➤
1.42
Les molécules b à d ont des liaisons polaires covalentes. Les liaisons carbone-hydrogène sont apolaires car le
carbone et l’hydrogène ont des électronégativités voisines. Les liaisons carbone-oxygène ou hydrogène-fluor
sont en revanche polaires.
➤
1.44
Référez-vous à la figure 1.12 de la page 17, qui présente les valeurs d’électronégativités des éléments dans la
classification périodique. Les éléments les plus électronégatif dans chacune des molécules sont en rouge.
a) CH
2
FCL b) FCH
2
CH
2
CH
2
Br c) HOCH
2
CH
2
NH
2
d) CH
3
OCH
2
Li
➤
1.45
© DUNOD 2008 - Chimie organique : Les grands principes - John McMurry et Eric Simanek

Solutions des exercices supplémentaires (sélection) – Mc Murry/Simanek – Dunod
3
➤
1.47
Attention la liaison carbone-soufre n’est pas polaire car ces deux éléments ont des électronégativités sembla-
bles (cf. figure 1.12).
Hybridation
➤
1.49
➤
1.51
a) CH
3
CH
2
CH=CH
2
b) H
2
C=CHCH=CH
2
c) H
2
C=CHC
≡
CH
Acide-Base
➤
1.52
Cette réaction se produit car l’acétone est un acide plus élevé que l’ammoniac
➤
1 .54
La réaction entre le méthanol et l’ion bicarbonate ne peut se produire dans le sens indiqué dans l’énoncé car
le méthanol est un acide plus faible que H
2
CO
3
.
© DUNOD 2008 - Chimie organique : Les grands principes - John McMurry et Eric Simanek
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
1
/
126
100%