OBSERVER – Couleurs et images

COMPRENDRE – Lois et modèles
Chap. 10 Dissolution de composés ioniques ou moléculaires
Essentiel Page 1 / 4 C. Grange-Reynas
L’essentiel
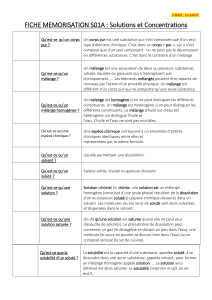
Vocabulaire
Interaction électrostatique : Interaction électromagnétique qui est régi par la loi de Coulomb.
Interactions de Van Der Waals : Interactions électrostatiques entre les nuages électroniques des
molécules (Interactions intermoléculaires). Interactions de très
faible intensité (portée inférieure au nanomètre) et attractives.
Liaison Hydrogène : Liaison qui se entre un atome d’hydrogène lié à un atome très électronégatif et un
autre atome très électronégatif d’une autre molécule.. Il s’agit d’une interaction
principalement électrostatique attractive. Sa portée est de l’ordre du dixième de
nanomètre. La liaison hydrogène est la plus forte des liaisons intermoléculaires
Solution : Mélange que l’on obtient lorsqu’on dissout une espèce chimique dans un liquide.
Soluté : Espèce chimique dissoute.
Solvant : Liquide dans lequel on dissout l’espèce chimique.
Solution aqueuse : Le solvant utilisé est l’eau.
Solution électrolytique : Solution qui conduit le courant électrique, qui contient des cations et anions
et qui est électriquement neutre.
Solubilité : C'est la quantité de matière maximale du composé qui peut être dissoute dans un litre de
solution, c'est à dire la quantité de composé nécessaire à la fabrication d'un litre de
solution saturée.
Solide ionique : (ou cristal ionique). Constitué d’un empilement compact régulier de cations et
d’anions, en nombres tels que la neutralité électrique du cristal est assurée.
Solide moléculaire : Solide constitué de molécules.
SAVOIR
I – Un solvant polaire
Un solvant constitué de molécules polaires est un solvant polaire.
Rappels : Molécule polaire
Le caractère polaire ou non d’une molécule dépend de la présence de liaisons polarisées et de la géométrie de la
molécule. Lorsque la molécule a un moment dipolaire non nul, elle est dite polaire.
Un solvant organique dont les molécules comportent un atome très électronégatif F, O, N ou Cl est
généralement polaire. Ex. : Eau, éthanol…
Un solvant constitué de molécules apolaires est un solvant apolaire.
Les solvants dont les molécules ne comportent que des atomes de carbone et d’hydrogène sont apolaires.
Exemples : Les molécules de cyclohexane, d’heptane, d’octane, … sont des molécules apolaires.

COMPRENDRE – Lois et modèles
Chap. 10 Dissolution de composés ioniques ou moléculaires
Essentiel Page 2 / 4 C. Grange-Reynas
II – Dissolution d’un solide ionique dans un solvant polaire
Un solide ionique ne se dissout pas (ou très peu) dans un solvant apolaire. La solubilité est effective s’il existe
des interactions entre le soluté et les molécules de solvant.
La dissolution d’un composé ionique dans un solvant polaire comprend trois étapes :
Etape 1 : dissociation du solide ionique
Un cristal ionique, constitué d’ions liés par des forces électrostatiques (1er schéma),
en étant en contact avec l'eau commence à se dissoudre. Pour nous, à l'œil nu, il
semble "disparaître" dans l'eau. En fait, le cristal est en cours de destruction : les ions
sont séparés les uns des autres par le solvant. Ils se libèrent dans le liquide, chacun
de leur côté : ils sont trop petits pour être visibles individuellement (2ème schéma).
Les interactions électriques qui apparaissent entre les molécules d’eau et les ions
fragilisent la structure du solide en affaiblissant les interactions électrostatiques
entre les ions.
Etape 2 : hydratation (ou solvatation) des ions
Les molécules d'eau étant polarisées, elles entourent chaque ion et le stabilise, ce qui
empêche les ions de se rapprocher pour se lier de nouveau. Elles s’orientent afin de
présenter le pôle de signe opposé à la charge de l’ion (elle s’associe aux ions positifs
par son côté Oxygène, « négatif », et aux ions négatifs par ses côtés Hydrogène, «
positif ») . Les ions sont dits solvatés (ou hydratés lorsque le solvant et l’eau). Cela
s'appelle l'hydratation (3ème schéma). Ils peuvent s’entourer de deux à dix
molécules d’eau.
Etape 3 : dispersion des ions
Sous l’effet de l’agitation thermique, les ions hydratés s’éloignent peu à peu les uns des autres. Ils se dispersent
dans le solvant. Ils ne sont plus du tout en interaction entre eux.
Bilan

COMPRENDRE – Lois et modèles
Chap. 10 Dissolution de composés ioniques ou moléculaires
Essentiel Page 3 / 4 C. Grange-Reynas
Équation d’une réaction de dissolution dans l’eau d’un solide ionique
Au cours d’une dissolution, il y a conservation de la matière et des charges électriques.
L’équation de dissolution d’un solide ionique de formule AX(s) constitué de cations A+ et d’anions X - s’écrit :
solide ionique ions solvatés ou AX (s) A +(aq) + X - (aq)
Une solution ionique est électriquement neutre : la quantité de charges élémentaires positives est égale à la
quantité de charges élémentaires négatives.
Un ion, une fois dissous dans le solvant, est dit solvaté. Si le solvant est l’eau, l’ion est dit hydraté : on écrit alors
« (aq) » à coté de sa formule.
III – Dissolution d’un solide moléculaire dans un solvant
Les solides moléculaires peuvent aussi se dissoudre dans des solvants. L’interaction entre les molécules de
solvant et de soluté est alors une interactions de Van der Waals, et éventuellement une interaction par liaison
hydrogène.
Dissolution d’un soluté polaire dans solvant polaire
♥♥♥ Les solutés moléculaires polaires sont solubles dans les solvants polaires. ♥♥♥
Cette solubilité s’explique par des liaisons de Van der Waals qui s’établissent entre les molécules de soluté et les
molécules de solvant. Exemple : La butanone (polaire) dans l’acétone (polaire). Dans certains cas, en plus, la
solubilité est favorisée par des liaisons hydrogène qui se créent entre les molécules de solutés et celles de
solvant. Exemple : Le sucre (saccharose) (polaire) dans l’eau (polaire).
Remarque : Ces liaisons hydrogène soluté – solvant sont parfois si fortes qu’elles cassent certaines liaisons
covalentes du soluté et on retrouve des ions en solution et non pas des molécules :
H2SO4 (ℓ)
→
2 H+ (aq)
+
SO42– (aq)
Dissolution d’un soluté apolaire dans solvant apolaire
♥♥♥ Les solutés moléculaires apolaires ou peu polaires sont généralement solubles dans les solvants
apolaires.♥♥♥ Exemple : La molécule de diiode I2, peu soluble dans l’eau, est très soluble dans le cyclohexane
C6H6 qui est un solvant apolaire.
Remarque : Un solvant apolaire ne peut pas donner lieu à des solutions électrolytiques car il ne permet pas la
dissolution de solides ioniques.
III – Détermination de la concentration d’un ion en solution
Concentration molaire en soluté apporté : C(S)
La concentration molaire d’une solution en soluté apporté est noté C(S). Elle est égale au rapport de la quantité
de soluté n(S) mise en solution par le volume Vsol de solution :
C(S) = 𝒏(𝒔)
𝑽𝒔𝒐𝒍 Avec : n(S) en mole (mol), Vsol en litre (L) et C(S) en mole par litre (mol.L-1)

COMPRENDRE – Lois et modèles
Chap. 10 Dissolution de composés ioniques ou moléculaires
Essentiel Page 4 / 4 C. Grange-Reynas
Concentration molaire effective des ions en solution : [X]
La concentration molaire effective (ou réelle) d’une espèce en solution est noté *X]. Elle est égale au rapport de
la quantité n(X) présente dans la solution par le volume Vsol de solution :
[X] = 𝒏(𝑿)
𝑽𝒔𝒐𝒍 avec n(X) en mole (mol), Vsol en litre (L) et [X] en mole par litre (mol.L-1)
Remarque : L’équation de dissolution ou l’écriture de la solution ionique permet de connaître le nombre
stœchiométrique correspondant à chaque ion. La concentration molaire effective d’un ion est alors le produit de
la concentration en soluté apporté par le nombre stœchiométrique.
1
/
4
100%