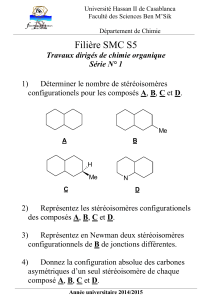
Chimie Organique : Exercices Oxydoréduction Alcènes

Chimie organique 4 :
Réactions d’oxydation et de réduction
de la double liaison C=C
Exercices d’entraînement
1. Utiliser les équations des réactions
Donner le (ou les) produit(s) majoritaire(s) des réactions réalisées sur le (Z) 3-méthylpent-2-ène. On précisera
la stéréochimie du produit dès que cela sera possible.
2. Catalyseurs de l’hydrogénation
1. Représenter schématiquement le mécanisme de l’hydrogénation d’un alcène en catalyse hétérogène.
2. Indiquer la formule spatiale des hydrocarbures obtenus par hydrogénation des composés insaturés
suivants, a) sur nickel de Raney, b) sur palladium de Lindlar. On supposera le dihydrogène en large excès.
3. Additions électrophiles sur un dérivé éthylénique chiral
1. Donner les produits obtenus lors de la transformation ci-dessous réalisée dans un solvant polaire, à
l’obscurité. On précisera ceux qui sont majoritaires.
Me
Me
H
HCl, gaz
?
a) Quelle relation stéréochimique lie les différents produits ?
b) Le mélange final est-il optiquement actif ?
c) Pourquoi la réaction est-elle réalisée à l’obscurité, dans un solvant polaire ?
2. En présence de peroxydes, quel(s) produit(s) obtiendrait-on ?
3. Quel(s) produit obtient-on par action de HClO et ICl sur le 1-méthylcyclohex-1-ène ?
1) O3
2) H2O2, H+
1) BH3
2) H2O2, HO-
HBr, CCl4
(PhCO2)2, hv
Br2
HCl
H2O2
1) O3
2) Zn, H+
1) mCPBA
2) H2O, H+
H2SO4, H2O
OsO4 cat.
OsO4 cat.
NaIO4

4. Hydroboration
1. Préciser la formule du (ou des) produit(s) majoritaire(s) obtenu(s) lors de la réaction d’hydroboration-
oxydation sur les composés suivants. Les descripteurs stéréochimiques seront précisés dès que possible.
2. L'hydroboration du 3-méthylcyclohexène par le borane (BH
3
) suivie de l'oxydation par le péroxyde
d'hydrogène en solution aqueuse basique conduit au mélange de produits suivants :
a) La réaction est-elle régiosélective ?
b) La réaction est-elle stéréosélective ?
c) Préciser la relation d'isomérie entre les différents produits obtenus.
d) Représenter les produits obtenus dans leur conformation la plus stable. On précise le groupement
hydroxyle est moins volumineux que le groupement méthyle.
5. Utilisation du clivage oxydatif pour déterminer la formule d’un alcène
1. Un hydrocarbure A a pour formule brute C
10
H
16
. L’hydrogénation catalytique complète nécessite deux
moles de dihydrogène par mole de composé A. Le traitement du composé A par de l’ozone, suivie d’une
hydrolyse en milieu réducteur, conduit à de la propanone et à du 5-méthyl-2-oxo-hexanedial.
a) En déduire les deux formules développées possibles pour A.
b) Le spectre RMN du composé A présente dans la zone 5-6 ppm un doublet et un doublet de doublet
intégrant chacun pour 1 H. Montrer que cette information permet d’identifier le composé A sans
ambiguïté.
2. B et C sont deux alcènes de formule C
8
H
16
. L’ozonolyse de B et C donne exclusivement un composé D dont
le spectre RMN présente les signaux suivants :
• triplet intégrant pour 3 H à δ = 1,1 ppm,
• singulet intégrant pour 3 H à δ = 2,2 ppm,
• quadruplet intégrant pour 2 H à δ = 2,4 ppm.
Par action du tétraoxyde d’osmium, on obtient pour B un composé achiral, et pour C un mélange
racémique.
Déterminer les formules de B et C.
6. Oxydation ménagée des alcènes
1. On considère l’hydrogénation catalytique sur palladium de Lindlar du hex-3-yne (noté A). Le produit
obtenu est le hex-3-ène, noté B. Soit C le diastéréoisomère de B.
a. Identifier B et C.
b. On réalise une époxydation séparément sur B et sur C. A partir de B, on obtient D et à partir de C, on
obtient E.
Comment réalise-t-on une époxydation ?
Identifier les formules de D et E.
Que dire de l’activité optique des mélanges finaux D et E ?
c. L’ouverture de l’époxyde D, par hydrolyse basique, conduit à un diol
α
F, tandis que celle conduite sur
E donne G. F et G diffèrent par leurs propriétés physiques : G est obtenu sous forme solide
(température de fusion égale à 90 °C), tandis que F est liquide.
Identifier F et G.
Ecrire le mécanisme de l’ouverture en milieu basique des époxydes.
Justifier leur obtention dans des états physiques différents.
Pourquoi la dihydroxylation d’un alcène est-elle considérée comme une réaction d’oxydation ?
2-méthylcyclohexanol 3-méthylcyclohexanol
cis 16 % 34 %
trans 18 % 32 %

2. Les alcènes se comportent en tant que réducteurs vis-à-vis du permanganate de potassium KMnO
4
, dilué et
froid en milieu alcalin (pH = 12). Dans ces conditions, B donne G et C donne F.
a. Ecrire l’équation de la réaction d’oxydation de C par le permanganate de potassium en milieu basique.
b. Que peut-on dire de la stéréochimie de la réaction ?
c. Par quel réactif peut-on remplacer le permanganate de potassium ? Décrire les conditions opératoires.
Exercices d’approfondissement
7. Rétrosynthèses
Proposer un substrat pour former le composé indiqué dans les conditions expérimentales choisies.
1. Synthèse du (2R,3S)-butane-2,3-diol par époxydation puis hydrolyse basique.
2. Synthèse du (2R,3R)-butane-2,3-diol par action du tétraoxyde d’osmium catalytique en présence de
péroxyde d’hydrogène.
Proposer une synthèse des composés suivants, en précisant les conditions expérimentales à mettre en œuvre.
3. Synthèse du propane-1,2-diol à partir du 1-chloropropane.
4. Synthèse du butane-2,3-diol à partir du but-1-ène.
5. Synthèse du butan-1-ol à partir de l’éthène.
8. Induction asymétrique
1. Les alkylboranes issus de l'action de l'hydrure de bore (ou borane) sur un alcène peuvent être isolés. Dans
le cas d'un alcène encombré, on peut facilement s'arrêter au dialkylborane qui peut ensuite être utilisé
comme réactif d'hydroboration d'un alcène.
a. Donner la formule semi-développée du dialkylborane obtenu par réaction de l'hydrure de bore sur le
2-méthylbut-2-ène.
b. Quel est l'intérêt de ces dialkylboranes, dans une hydroboration, par rapport au borane ?
2. Un des défis de la synthèse organique est de favoriser l'obtention d'un énantiomère (et non d'un mélange
racémique) à partir d'un substrat achiral. Il y a alors « induction asymétrique ».
a. On caractérise les mélanges de deux énantiomères, aux concentrations respectives [+] pour le composé
dextrogyre et [-] pour le composé lévogyre, par l'excès énantiomérique ee, qui s'exprime en
pourcentage, par :
= |+− −|
++ −
Calculer ee dans les trois cas suivants : mélange racémique, composé énantiopur, puis mélange 90/10.
b. En s'appuyant sur l'exemple du 2-méthylbut-2-ène, expliquer pourquoi une hydroboration « normale »
donne un mélange racémique.
3. L'α-pinène, un des principaux composés de l'essence de térébenthine, fait partie du « pool chiral»
(composés naturels optiquement actifs et peu onéreux). Sa structure est indiquée ci-dessous :
d. Combien d’atomes de carbone asymétriques possède-t-il ? Combien existe-t-il de stéréoisomères de
configuration ?
e. Sans s'intéresser à la stéréochimie, donner la formule semi-développée du dialkylborane A obtenu par
action du borane sur l'α-pinène.
f. L'action de l'eau oxygénée en milieu basique sur A conduit à un alcool B. L'hydroboration de l'α-pinène
est stéréosélective à plus de 99 %. Dessiner le stéréoisomère de configuration majoritairement obtenu
et justifier.
4. Le dialkylborane A est un des plus efficaces réactif d'induction asymétrique. Ce dernier réagit avec le
2-méthylbut-1-ène, pour donner, après hydroboration, un alcool possédant un excès énantiomérique de
21 % en stéréoisomère (R). Dessiner ce stéréoisomère en projection de Cram et calculer les pourcentages
de chaque énantiomère.

9. Détermination de structure
On souhaite déterminer la structure d'une substance naturelle A, présente dans une algue marine de type
dictoperis. A s’y trouve sous la forme d'un mélange racémique de deux énantiomères notés A
1
et A
2
. L'analyse
élémentaire a permis de lui attribuer la formule brute C
11
H
20
O.
1. En présence d'un métal alcalin comme le sodium, A donne une réaction vive avec dégagement gazeux. A
soumis à l'action du dichromate de potassium en solution aqueuse acide, donne un composé identifiable à
un acide carboxylique. Quelle est la fonction mise en évidence par ces réactions ? Donner la nature du gaz
apparu lors de la réaction avec le sodium et expliquer sa formation.
2. Le passage de A sur alumine Al
2
O
3
à 400°C conduit à un composé B de formule brute C
11
H
18
. Quelle est la
nature de cette réaction et le type de produit obtenu ?
3. L'ozonolyse de B donne, après une hydrolyse en présence d’un oxydant, un mélange de 3 composés : deux
monoacides carboxyliques D (CH
2
O
2
) et E (C
5
H
10
O
2
: acide pentanoïque) et un diacide carboxylique F
(C
5
H
6
O
4
). Donner une formule semi-développée pour F. Montrer qu'il existe pour F trois stéréoisomères F
1
,
F
2
et F
3
dont deux sont des inverses optiques. Les représenter dans l'espace en précisant quand cela est
utile les configurations R et S des carbones.
4. L'isomère de F produit ici est le seul stéréoisomère achiral. En déduire la structure de F.
5. Des structures semi-développées de D, E et F, déduire celles de B et A. Montrer qu'à la formule semi-
développée de A peuvent correspondre quatre stéréoisomères (la substance naturelle A n'étant constituée
que de deux d'entre eux). Représenter ces quatre stéréoisomères en précisant les relations de
stéréoisomérie (la configuration absolue des carbones asymétriques n'est pas demandée).
6. L'addition de dibrome sur la substance naturelle A conduit à un mélange équimolaire de composés dont les
carbones bromés sont de configuration R,R et S,S. Quelle relation d'isomérie existe entre les composés
obtenus ?
7. En déduire les deux formes A
1
et A
2
constituant le mélange racémique à identifier.
10. Hydrogénation sélective
1. Quelle réaction se déroule entre les réactifs suivants, dans le toluène à 100 °C ? Donner la formule de A.
MeO
O
O
(C
19
H
18
O
3
)
A
+
2. Dans des conditions expérimentales convenables, une mole de A peut être très facilement hydrogénée par
une mole de dihydrogène en présence de palladium sur charbon pour donner le composé B. La bande
d’absorption IR du carbonyle se déplace de 1640 à 1670 cm
-1
. En déduire la formule de B.
11. Autour des alcènes
Le dibrome réagit avec les alcènes dans un solvant inerte comme le tétrachlorure de carbone (réaction 1).
1. Détailler le mécanisme de cette réaction. Donner la structure du produit A obtenu à partir du
2,3-diméthylbut-2-ène.
Conduite dans l'eau comme solvant, l'action du dibrome sur le 2,3-diméthylbut-2-ène ne conduit pas au
produit A obtenu dans la réaction 1, mais à un bromoalcool B par un mécanisme analogue. Le composé A n'est
pas un intermédiaire dans ces conditions expérimentales.
2. Détailler le mécanisme de formation du bromoalcool B et donner sa structure.
3. Justifier le qualificatif inerte pour le solvant employé dans la réaction 1 (le tétrachlorure de carbone)
On considère le composé C représenté ci-dessous :
4. C est-il chiral ? Pourquoi ?
5. C peut-il être obtenu - entre autres produits - par action du dibrome sur le 1,2,4-triméthylcyclopentène en
solution aqueuse ? Si oui, est-il le produit majoritaire ? Sinon, pour quelle raison ?

Le composé C est traité par une solution aqueuse de soude (NaOH) diluée (réaction 2). On obtient un mélange
de 2 stéréoisomères D
1
et D
2
de formule moléculaire C
8
H
16
O
2
.
6. Quel est le nom de la réaction 2 ? Détailler son mécanisme et donner la structure de D
1
et D
2
, sachant que
les carbones asymétriques de D
1
sont de configuration (R,S).
7. D
1
et D
2
sont-il chiraux ? Quelle relation existe-t-il entre D
1
et D
2
?
8. Le mélange de D
1
et D
2
obtenu est-il optiquement actif ? Pourquoi ?
9. Proposer une préparation de D
1
à partir du 1,2,4-triméthylcyclopentène. Obtient-on uniquement le
composé D
1
dans cette réaction ? Sinon, représenter le ou les autres composés formés en même temps
que D
1
et préciser le produit majoritairement obtenu.
10. Proposer une préparation du composé D
2
à partir du 1,2,4-triméthylcyclopentène. Obtient-on uniquement
le composé D
2
dans cette réaction ? Sinon, représenter le ou les autres composés formés en même temps
que D
2
et préciser le produit majoritairement obtenu.
On effectue ensuite une autre réaction sur C (DMSO = diméthylsufoxyde) :
E + E
12
MeOK
DMSO
C (réaction 3)
Les composés obtenus E
1
et E
2
sont isomères de formule moléculaire C
8
H
14
O. E
1
est le composé majoritaire
obtenu dans cette réaction, c'est également l'isomère le plus stable.
11. Quel est le nom de la réaction 3 ? Détailler son mécanisme et donner la structure de E
1
et E
2
.
12. Pourquoi E
1
est-il majoritaire ?
Le composé E
1
est ensuite chauffé en milieu acide (réaction 4). On obtient un composé unique F dont la
structure a été déterminée par ozonolyse suivie d'une hydrolyse en milieu réducteur (réaction 5) :
13. Déduire du résultat de la réaction 5 la structure de F et donner son nom en nomenclature systématique.
14. Pourquoi est-il nécessaire de procéder à une hydrolyse en milieu réducteur après l'ozonolyse ? Quel
réducteur peut-on employer ?
15. Déduire de la structure de F le mécanisme détaillé de la réaction 4. Précise le nom de cette réaction.
16. Justifier la formation du composé F comme produit unique de la réaction 4.
17. Dans les conditions de la réaction 4, E
2
conduit également à F. Expliquer.
1
/
5
100%