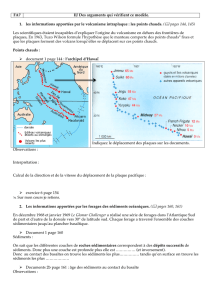
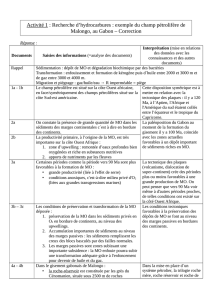
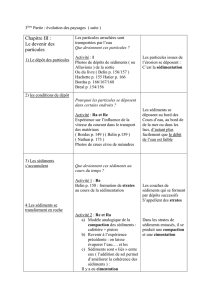
étude sur la biodisponibilité des métaux dans les sédiments

www.eau-artois-picardie.fr
ÉVALUATION DE LA BIODISPONIBILITÉ
DES MÉTAUX DANS LES SÉDIMENTS
2010


(YDOXDWLRQGHODELRGLVSRQLELOLWpGHVPpWDX[GDQV
OHVVpGLPHQWV
3KDVH,,²5DSSRUWILQDO
Rapport Scientifique
G. Billon, R. Descamps, C. Grare, B. Ouddane et J-C. Fischer
Juillet 2010
Gabriel Billon
USTL/Géosystèmes/ECAM
Cité Scientifique, Bât C8, 2
ème
étage
gabriel.billon@univ-lille1.fr
Tel : +33 (0)3 20 43 49 28
Fax : +33 (0)3 20 43 48 22
Gé systèmes
FRE 3298 CNRS-LILLE1

ii

iii
REMERCIEMENTS
Nous tenons à remercier tout d’abord M. Jean Prygiel, chef de service Ecologie du Milieu de l’Agence
de l’Eau Artois-Picardie pour l’aide apportée tout au long de ce travail réalisé dans le cadre de la
convention de coopération USTL-Agence de l’Eau (convention de coopération 64556).
Un grand merci également à Michel Arold de l’Agence de l’Eau Artois-Picardie pour son aide sans
faille lors des prélèvements sur l’ensemble du territoire de la région Nord Pas-de-Calais.
Enfin, je tiens à remercier très chaleureusement M. Yue Zhu, étudiant en Master II dans notre équipe,
ainsi que M. Pierre-Jean Superville, étudiant à l’Ecole Nationale Supérieure de Chimie de Lille, pour
les centaines d’analyses effectuées sur les sédiments et les eaux interstitielles et surnageantes.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%