1. Forces entre ions

Etats de la matière
Cours de Biophysique
1ère année Médecine
N BEN RAIS AOUAD 1
Mme le Professeur N. BEN RAIS AOUAD

Mme Pr N Ben Raïs Aouad
Directeur de la Formation et la recherche en
biophysique et médecine nucléaire
Faculté de médecine et de pharmacie Rabat
Chef de service de médecine nucléaire
N BEN RAIS AOUAD 2
Chef de service de médecine nucléaire
Hôpital Ibn SINA Rabat
Equipe de médecine nucléaire Ibn Sina
Pr N Ben Rais,Pr As I Ghfir, Pr As H Guerrouj

Plan
I. Généralités
II. Liaisons intermoléculaires
A
-
Causes d’attraction
N BEN RAIS AOUAD 3
A
-
Causes d’attraction
B- Causes de répulsion
III. Notions élémentaires de certains
changements d’état
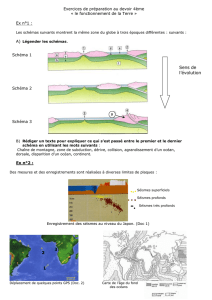
A- Transfert réciproque Solide-Liquide
B- Transformation Liquide -Vapeur

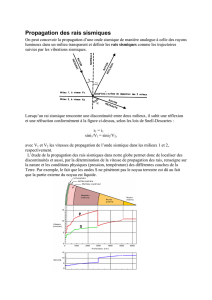
I- Généralités:
• Selon les conditions physiques (température,
pression…...), la matière peut se trouver
généralement sous
3
états
:
solide
,
liquide
N BEN RAIS AOUAD 4
généralement sous
3
états
:
solide
,
liquide
ou gazeux.
• Dans ces différents états, les molécules sont
les mêmes: la différence dépend de la nature
des interactions entre les molécules.

I- Généralités:
•Un état de la matière est la conséquence
d’une compétition
entre
des forces d’attraction
N BEN RAIS AOUAD 5
d’une compétition
entre
des forces d’attraction
qui tendent à rapprocher les particules et des
causes d’éloignement qui les dissocient.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%