lilly - E-compendium.be

Société pharmaceutique
(LILLY)
1. DENOMINATION DU MEDICAMENT
Humatrope 6 mg, poudre et solvant pour solution injectable
Humatrope 12 mg, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Humatrope 6mg : cartouche contenant 6 mg de somatropine
Après reconstitution, contient 2,08 mg/ml.
Humatrope 12 mg : cartouche contenant 12 mg de somatropine
Après reconstitution contient 4,17 mg/ml.
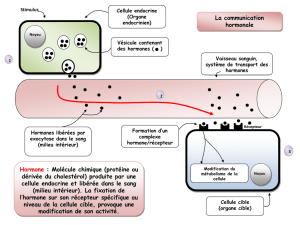
La somatropine est obtenue par la technique de l’ADN recombinant sur souche d’Escherichia coli.
Humatrope contient moins de 1millimole de sodium par dose, ce qui est équivaut à une quantité négligeable de sodium
Pour la liste complète des excipients, voir rubrique 6.1
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable.
La poudre est blanche à blanchâtre. Le solvant est une solution transparente.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Patients pédiatriques :
Humatrope est indiqué:
- dans le traitement à long terme des enfants présentant un retard de croissance provoqué par une sécrétion insuffisante d'hormone de
croissance endogène;
- en cas de retard de croissance associé à un syndrome de Turner, confirmé par analyse chromosomique;
- en cas de retard de croissance associé à une insuffisance rénale chronique chez des enfants prépubères.
- dans le traitement des patients présentant un défaut de croissance associé à une déficience SHOX confirmée par une analyse ADN.
- en cas de retard de croissance (taille actuelle < -2,5 SDS (Score de Déviation Standard) et taille des parents ajustée < -1 SDS) chez
les enfants nés petits pour l’âge gestationnel (Small For Gestational Age : SGA) avec un poids et/ou une taille de naissance < -2 DS,
n’ayant pas rattrapé leur retard de croissance (vitesse de croissance < 0 SDS au cours de la dernière année) à l’âge de 4 ans ou plus.
Patients adultes :
Humatrope est indiqué pour une thérapie de substitution chez les adultes avec une déficience prononcée en hormone de croissance.
Les patients, avec une déficience sévère en hormone de croissance à l'âge adulte, sont définis comme des patients présentant une
pathologie hypothalamo-hypophysaire connue et au moins une déficience connue en hormone hypophysaire à l’exclusion de la
prolactine. Ces patients devraient subir un seul test dynamique afin de diagnostiquer ou d'exclure une déficience en hormone de
croissance. Chez les patients avec une déficience en hormone de croissance isolée, ayant débuté au cours de l'enfance (sans évidence
de maladie hypothalamo-hypophysaire ou d'irradiation du crâne) deux tests dynamiques devraient être recommandés, sauf pour les
patients ayant des concentrations basses en IGF-1 (<2 déviations standards) chez qui un seul test pourrait être considéré. La valeur de
mesure limite du test dynamique définissant le diagnostic devrait être stricte.
4.2 Posologie et mode d’administration
Humatrope s’administre par voie sous-cutanée après reconstitution.
La posologie doit être adaptée à chaque patient selon ses besoins.
Population pédiatrique : déficit en hormone de croissance
La dose recommandée est de 0,025-0,035 mg par kilo de poids corporel par jour, en injection sous-cutanée. Ceci est l’équivalent de
0,7-1,0 mg/m
2 environ, de surface corporelle, par jour.

Patients adultes: déficit en hormone de croissance
La dose recommandée pour initier le traitement est de 0,15-0,30 mg/jour. Une dose inférieure pourrait être nécessaire chez les patients
âgés et obèses.
La dose pourra être augmentée graduellement, en fonction des besoins sur base de la réponse clinique et des concentrations d’IGF-1.
La dose journalière totale ne doit pas excéder 1 mg. Les concentrations d’IGF-1 devraient être maintenues sous la limite supérieure
des valeurs normales pour l’âge.
La dose minimale efficace doit être utilisée; celle-ci peut diminuer avec l’âge.
La dose de somatropine devrait être diminuée en cas d’œdème persistant ou de paresthésies sévères, afin d’éviter le développement
d’un syndrome du canal carpien.(voir rubrique 4.8)
Patients avec le Syndrome de Turner
La dose recommandée est de 0,045-0,050 mg par kg de poids corporel ou 1,4 mg/m
2 par jour, en injection voie sous-cutanée, de
préférence le soir.
Patients pédiatriques prépubères avec insuffisance rénale chronique
La dose recommandée est de 0,045-0,050 mg/kg de poids corporel par jour administré en injection voie sous-cutanée.
Patients pédiatriques avec une déficience SHOX
La posologie recommandée est de 0,045-0,050 mg/kg de poids corporel par jour administrée par injection voie sous-cutanée.
Retard de croissance chez les patients pédiatriques nés petits pour l’âge gestationnel (SGA)
La posologie recommandée est de 0,035 mg/kg de poids corporel par jour (1 mg/m
2 de surface corporelle par jour), administrée sous
forme d’injection voie sous-cutanée, jusqu’à ce que la taille finale soit atteinte (voir rubrique 5.1).
Le traitement devra être interrompu après la première année de traitement si le SDS de la vitesse de croissance est inférieur à + 1
SDS. Le traitement devra être interrompu si la vitesse de croissance est < 2cm/an et, si une confirmation est nécessaire, l’âge osseux
est > 14 ans (pour les filles) et > 16 ans (pour les garçons), correspondant à la soudure des épiphyses.
Il est recommandé de ne pas piquer chaque fois au même endroit afin d'éviter une atrophie des tissus adipeux.
Pour les instructions de reconstitution du médicament avant administration, voir rubrique 6.6.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
La somatropine ne doit pas être utilisée en présence d’une preuve quelconque d’activité d’une tumeur. Les tumeurs intracrâniennes
doivent être inactives et tout traitement anti-tumoral doit être terminé avant de commencer un traitement par l’hormone de croissance.
Le traitement doit être interrompu en présence d’une preuve de croissance tumorale.
Ne pas utiliser Humatrope reconstitué avec son solvant chez des patients présentant une sensibilité connue au métacrésol et/ou au
glycérol.
Ne pas utiliser Humatrope chez les enfants avec des épiphyses fusionnées.
Ne pas initier un traitement d’Humatrope chez des patients en situation critique aiguë à la suite des complications liées à une
intervention à cœur ouvert ou sur l’abdomen ou à la suite d’un polytraumatisme, ou à des patients en insuffisance respiratoire aiguë
(voir rubrique 4.4).
4.4 Mises en garde spéciales et précautions d’emploi
La dose maximale quotidienne recommandée ne doit pas être dépassée (voir rubrique 4.2).
Les patients qui auraient été traités par hormone de croissance durant leur enfance jusqu'à obtention de la taille finale devraient être
l'objet d'une réévaluation du déficit en hormone de croissance après fusion des épiphyses, avant que le traitement de substitution ne soit
éventuellement initié à la dose recommandée pour l'adulte.
Le diagnostic et le traitement avec Humatrope doit être initié et contrôlé par des médecins qui sont pertinemment qualifiés et
expérimentés dans le diagnostic et le traitement de patients souffrant de déficience en hormone de croissance.
A l’heure actuelle, il n’existe pas de données permettant de suspecter que le traitement par l’hormone de croissance influence le taux
de récidives ou la progression de néoplasmes intracrâniens. Cependant, les standards de pratique clinique exigent des examens
réguliers d’imagerie pituitaire chez des patients présentant un historique de pathologie pituitaire. Un CT-scan de référence est
recommandé chez les patients avant l’institution d’une hormonothérapie de remplacement.

Un risque plus élevé de second néoplasme (bénin ou malin) a été rapporté chez les patients traités par somatropine, ayant survécu à un
cancer durant leur enfance. Parmi ces seconds néoplasmes, les tumeurs intracrâniennes, en particulier, ont été les plus fréquentes.
Une fundoscopie pour détecter un éventuel papilloedème est recommandée en cas de maux de tête sévères et récurrents, de
problèmes visuels, de nausées ou de vomissements. Un diagnostic d'hypertension intracrânienne bénigne doit être envisagé en cas de
confirmation de papilloedème et si cela s’avère approprié, le traitement par hormone de croissance devra être interrompu.
Les données actuelles sont insuffisantes pour asseoir une décision clinique chez les patients présentant une hypertension intracrânienne
résolue. Si le traitement par l'hormone de croissance est rétabli, un suivi attentif des symptômes de l'hypertension intracrânienne est
nécessaire.
Les patients souffrant de troubles endocriniens, incluant une déficience en hormone de croissance, peuvent développer plus
fréquemment un déplacement du plateau épiphysaire fémoral. Tout enfant qui commencerait à boiter en cours de traitement devrait être
évalué.
L’hormone de croissance accroît la conversion extrathyroïdienne de T4 en T3 et peut, de ce fait, révéler une hypothyroïdie débutante.
Un suivi de la fonction thyroïdienne devrait donc être réalisé chez tous les patients. Chez les patients hypothyroïdiens, le traitement
standard de substitution en hormones thyroïdiennes doit être étroitement surveillé, lors de la co-administration d’hormone de
croissance.
Chez les enfants, le traitement devrait être poursuivi jusqu'à la fin de la croissance. Il est conseillé de ne pas dépasser les doses
recommandées vu les risques potentiels d'acromégalie, d'hyperglycémie et de glycosurie.
En cas de retard de croissance, indirectement lié à une insuffisance rénale chronique, les patients doivent être suivis pendant un an avant
d’initier un traitement à la somatropine, afin de confirmer le trouble de croissance. Dans le but de préserver la fonction rénale, un
traitement conservatif de l’insuffisance rénale (incluant le contrôle de l’acidose, l’hyperparathyroïdisme, et l’état nutritionnel un an avant
le traitement) doit être établi et maintenu pendant tout le traitement à la somatotropine. La somatotropine doit être arrêtée au moment
de la transplantation rénale.
Les effets de l’hormone de croissance dans un contexte de convalescence ont été étudiés lors de deux essais cliniques contrôlés contre
placebo impliquant 522 patients adultes dont l’état critique était dû à des complications d’opérations à cœur ouvert ou abdominales,
des polytraumatismes ou à des insuffisances respiratoires aiguës. La mortalité était plus élevée (41,9% par rapport à 19,3%) chez les
patients traités à l’hormone de croissance (doses de 5,3-8 mg par jour) en comparaison avec ceux qui ont reçu un placebo.
On n’a pas établi l’innocuité d’un traitement continu chez les patients recevant des doses de substitution dans les indications
approuvées et ayant développé ce type de maladie.
Ainsi, chez les patients en état critique aigu, il faut mettre en balance le bénéfice potentiel de la poursuite du traitement par rapport au
risque potentiel encouru.
Selon la dose et la voie d’administration, une thérapie oestrogénique peut affecter la réponse au traitement à l’hormone de croissance.
Des doses supérieures d’hormone de croissance peuvent être requises afin d’obtenir une augmentation équivalente d’IGF-I sérique
chez les femmes, par rapport aux hommes, et ce tout spécialement chez les femmes recevant une oestrogénothérapie de substitution.
Si un changement se fait au niveau de la voie d’administration des oestrogènes (orale vers transdermique ou inversément) l’hormone de
croissance devra être à nouveau titrée (voir rubrique 4.5).
Une sensibilité accrue au cours du temps à l’hormone de croissance (exprimée en changement du taux d’IGF-I sérique obtenu par
dose d’hormone de croissance) peut être observée, plus particulièrement chez les hommes.
A moins que les patients avec un syndrome de Prader-Willi ne présentent également un diagnostic de déficience de l’hormone de
croissance, Humatrope n’est pas indiqué pour le traitement des patients avec une insuffisance de croissance liée à un syndrome de
Prader-Willi génétiquement confirmé.
Des cas d’apnée du sommeil et de mort subites ont été rapportés après une initiation du traitement avec hormone de croissance chez
des patients Prader-Willi présentant un ou plusieurs des facteurs de risque suivants : obésité sévère, anamnèse d’obstruction des voies
respiratoires supérieures ou apnée du sommeil, ou infection respiratoire non identifiée.
La somatropine pouvant réduire la sensibilité à l’insuline, les patients doivent être suivis afin de détecter une intolérance glucidique.
Chez les patients diabétiques, il peut s’avérer nécessaire d’ajuster la dose d’insuline après l’instauration d’un traitement par la
somatropine. Les patients diabétiques ou intolérants glucidiques doivent être étroitement suivis durant le traitement par la somatropine.
Les patients âgés (âge ≥ 65 ans) sont plus sensibles à l’action de l’Humatrope. Ils peuvent être plus sujets au développement d’effets
indésirables.
L’expérience chez les patients de plus de 80 ans est limitée.
Il n’y pas de données sur le traitement à long terme chez l’adulte.

Chez les enfants nés petits pour l’âge gestationnel, les autres causes médicales ou traitements pouvant expliquer ce retard de croissance
devront être exclues avant d’initier le traitement.
Chez des enfants nés petits pour l’âge gestationnel, il est recommandé de mesurer l’insulinémie et la glycémie à jeun avant de
commencer le traitement puis annuellement. Chez les patients présentant un risque accru de diabète (par exemple, des antécédents
familiaux de diabète, une obésité, une insulinorésistance sévère, de l’acanthosis nigricans), une épreuve d’hyperglycémie provoquée par
voie orale ( HPO) doit être effectuée. Si un diabète clinique apparaît, l’hormone de croissance ne devra pas être administrée tant que
patient n’a pas été stabilisé pour le traitement du diabète. L’hormone de croissance peut être introduite sous monitoring précis du
contrôle du diabète. Une augmentation du dosage de l’insuline peut être requise.
Chez les enfants nés petits pour l’âge gestationnel, il est recommandé de mesurer le taux plasmatique d’IGF-I avant d’initier le
traitement, et par la suite 2 fois par an. Si sur des mesures répétées, les taux d’IGF-I sont supérieurs à + 2 DS par rapport aux valeurs
standard pour le sexe, l’âge et l’âge pubertaire, le ratio IGF-I/IGFBP-3 devrait être pris en considération pour l’ajustement de la dose.
Le traitement par l’Humatrope en période péri-pubertaire chez des patients nés petits pour l’âge gestationnel et chez les patients avec
une déficience SHOX n’est pas recommandé vu l’expérience limitée.
Une partie du gain de taille chez les enfants de petite taille nés petits pour l’âge gestationnel traités par l’hormone de croissance pourrait
être perdue si le traitement est interrompu avant que la taille finale ne soit atteinte.
Pancréatite chez les enfants
Les enfants traités par somatropine ont un risque accru de développer une pancréatite comparés aux adultes traités par somatropine.
Bien que rare, une pancréatite devrait être envisagée chez les enfants traités par somatropine qui présentent une douleur abdominale.
Aggravation de la scoliose chez les enfants
Une scoliose peut s’aggraver chez tout enfant lors d’une croissance rapide. Les signes de scoliose doivent être suivis durant le
traitement.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
Les patients diabétiques recevant simultanément de la somatropine peuvent nécessiter un ajustement de leurs doses d’insuline et/ou de
leurs autres médicaments hypoglycémiants.
Si un traitement de remplacement par glucocorticoïdes est requis, le dosage des glucocorticoïdes et la compliance doivent faire l’objet
d’un monitoring précis afin d ‘éviter une insuffisance surrénale ou une inhibition des effets favorisant la croissance. Chez les patients
traités par somatropine non diagnostiqués auparavant, un hyposurrénalisme secondaire peut être démasqué, nécessitant le recours à un
traitement de substitution par glucocorticoïdes.
Chez les femmes sous oestrogénothérapie, une dose supérieure d’hormone de croissance pourrait être requise pour atteindre l’objectif
thérapeutique (cfr. 4.4).
La somatropine peut augmenter l’activité de l’enzyme cytochrome P450 (CYP) chez l’Homme et peut conduire à une diminution des
concentrations plasmatiques et à une diminution de l’efficacité des médicaments métabolisés par le CYP3A tels que les stéroïdes
sexuels, les corticostéroïdes, la cyclosporine et les anticonvulsivants.
4.6 Fertilité, grossesse et allaitement
Des études de reproduction chez l’animal n’ont pas été conduites avec Humatrope. Nous ne savons pas si Humatrope peut causer un
dommage au foetus lorsqu’il est administré à une patiente enceinte ou s’il peut affecter la capacité de reproduction.
Humatrope ne devrait être administré à une femme enceinte qu’en cas de nécessité.
Aucune étude n’a été conduite avec Humatrope en cas d’allaitement. Nous ne disposons d’aucune information sur le passage éventuel
de ce médicament dans le lait maternel. Comme beaucoup de médicaments sont excrétés dans le lait maternel, la prudence est de
vigueur lorsque Humatrope est administré en cas d’allaitement.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Humatrope n’a aucun effet connu sur l’aptitude à conduire des véhicules ou à utiliser des machines.
4.8 Effets indésirables
La liste suivante détaille les effets indésirables ainsi que leur fréquence :
Affections du système immunitaire
Hypersensibilité aux solvants (métacrésol/glycérol) : 1% - 10 %
Affections endocriniennes

Hypothyroïdie : 1 % - 10 %
Affections des organes de reproduction et du sein
Gynécomastie : < 0.01 % chez l’enfant; 0.1 % - 1 % chez l’adulte
Troubles du métabolisme et de la nutrition
Hyperglycémie modérée : 1 % chez l’enfant; 1 % - 10 % chez l’adulte
Diabète de type 2 : 0.1% - 1% chez l’enfant ; des cas adultes ont été rapportés spontanément, avec une fréquence inconnue
Résistance à l’insuline
Affections du système nerveux
Hypertension intracrânienne bénigne : 0.01 % - 0.1 %
Maux de tête : > 10 % chez l’adulte
Insomnies : < 0.01 % chez l’enfant; 1 % - 10 % chez l’adulte
Paresthésies : 0.01 % - 0.1 % chez l’enfant; > 10 % chez l’adulte
Syndrome du canal carpien : 1%-10% chez l’adulte
Affections vasculaires
Hypertension : < 0.01 % chez l’enfant; 1 % - 10 % chez l’adulte
Affections respiratoires, thoraciques et médiastinales
Dyspnée : 1%- 10% adultes
Apnée du sommeil : 1%- 10% adultes....
Affections musculo-squelettiques et systémiques
Douleur musculaire localisée (myalgie) : 1 % - 10 % chez l’adulte, 0,01%-0,1% chez l’enfant
Arthrite, douleur et troubles articulaires : > 10 % chez l’adulte
Aggravation de la scoliose : 1%-10% chez les enfants
Troubles généraux et anomalies au site d’administration
Faiblesse : 0.1 %- 1 %
Douleur au site d’injection (réaction) : 1 % - 10 %
Oedème (local et généralisé) : 1 % - 10 % chez l’enfant; 10 % chez l’adulte
Investigations
Glycosurie : < 0.01 % chez l’enfant; 0.01 – 0.1 % chez l’adulte
Population pédiatrique
Lors des essais cliniques, environ 2% des patients déficitaires en hormone de croissance
endogène, traités par Humatrope, ont développé des anticorps à l'hormone de croissance. Lors
des essais cliniques chez les patients atteints du syndrome de Turner - indication dans laquelle les
doses administrées sont plus importantes - jusqu'à 8% de ces patients ont développé des
anticorps à l'hormone de croissance. Ces anticorps n'ont qu'une faible capacité de liaison et n'ont
pas interféré dans la réponse thérapeutique. La recherche des anticorps à l'hormone de
croissance devrait être entreprise chez les patients qui ne répondent pas au traitement.
Un léger œdème transitoire précoce a été observé en cours de traitement.
Un petit nombre de cas de leucémie a été observé chez des enfants traités par hormone de
croissance. Il n’a pas été démontré que l’incidence de leucémie soit accrue chez les patients
traités à l’hormone de croissance et ne présentant pas de facteurs prédisposants.
Patients adultes
Chez les patients pour lesquels le déficit en hormone de croissance s'est produit à l'âge adulte, les
cas d'oedème, de douleur musculaire, de douleur et trouble articulaire ont été rapportés en début
de traitement et tendaient à être transitoires.
Les patients adultes traités par hormone de croissance, suite à un diagnostic de déficit en
hormone de croissance posé pendant leur enfance, rapportent moins d'effets secondaires que
ceux dont le déficit est diagnostiqué à l'âge adulte.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue
 6
6
 7
7
 8
8
1
/
8
100%