3 h 30 min Date : vendredi 8 janvier 2016

Documents de Physique-Chimie – M. MORIN
1
Devoir de Physique-Chimie DST2
TS
Durée : 3 h 30 min Date : vendredi 8 janvier 2016
M. MORIN
Les calculatrices sont autorisées
I. Aie ! J’ai une crampe. 7,5 points.
Lors du métabolisme basal de l’homme, l’énergie nécessaire provient de la transformation en milieu oxygéné du glucose en
dioxyde de carbone et eau. Le dioxyde de carbone est transporté par le sang jusqu’aux poumons où il est alors éliminé par
ventilation.
Lors d’un effort physique intense, les besoins énergétiques des muscles augmentent : le métabolisme basal augmente ainsi que
la ventilation.
Dans certains cas, lorsque la ventilation est insuffisante, l’énergie nécessaire au fonctionnement du muscle devient insuffisante :
la crampe apparaît. Il se forme, dans la cellule musculaire, de l’acide lactique qui lorsqu’il passe dans le sang, provoque une
diminution locale de son pH du fait de la création en abondance de dioxyde de carbone dissous dans le sang Cette diminution du
pH sanguin déclenche des ordres hypothalamiques qui vont amplifier la ventilation.
Le but de cet exercice est d’expliquer, de façon très simplifiée, les processus mis en jeu lors de l’apparition d’une crampe.
1. pH du sang et maintien de sa valeur.
Le sang est constitué d’un liquide plasmatique (contenant entre autres les globules et les plaquettes), qui peut être assimilé à
une solution aqueuse ionique dont le pH (d’une valeur voisine de 7,4) est quasiment constant et ne peut subir que de très
faibles fluctuations. Dans le cas contraire, de fortes fluctuations nuiraient gravement à la santé.
Le maintien de la valeur du pH se fait par deux processus :
- Le premier met en œuvre un ensemble d’espèces chimiques régulatrices dont notamment le couple acide-base
CO2, H2O / HCO3- (couple dioxyde de carbone dissous / ion hydrogénocarbonate) grâce à l’équilibre :
CO2, H2O(aq) + H2O(l) HCO3–(aq) + H3O+(aq) (réaction 1).
- Le deuxième processus physico-chimique est la respiration.
A une température de 37°C on donne :
- pH d’un sang artériel « normal » : 7,4
- pKa(CO2, H2O / HCO3–) = 6,1
1.1. a) Donner l’expression de la constante d’acidité Ka1 associée au couple régulateur (réaction 1).
En déduire la relation entre le pH et le pKa1 du couple CO2, H2O / HCO3–. (La démonstration n’est pas demandée).
b) Calculer alors la valeur du rapport
dans le sang artériel normal.
c) Lors d’un effort physique, la concentration en dioxyde de carbone dissous dans le sang, au voisinage du muscle,
augmente. Comment devrait varier le pH du sang ?
Pour éviter cette variation du pH du sang, l’hémoglobine contenue dans ce dernier et la respiration interviennent pour éliminer
l’excès de dioxyde de carbone.
Le transport des gaz dissous dans le sang peut être modélisé par l’équilibre :
HbO2 + CO2 HbCO2 + O2 (réaction 2)
Où Hb représente l’hémoglobine du sang.
1.2. Répondre qualitativement aux questions suivantes :
a) Au voisinage du poumon la quantité de O2 dissous augmente. Dans quel sens est déplacé l’équilibre 2 ?
b) Au voisinage du muscle la quantité de CO2 dissous augmente Dans quel sens est déplacé l’équilibre 2 ?
c) Expliquer comment la respiration permet de maintenir constante la valeur du pH sanguin.

Documents de Physique-Chimie – M. MORIN
2
2. L’acide lactique.
L’acide lactique a pour formule CH3–CHOH–COOH.
2.1. Étude de la molécule d’acide lactique.
2.1.1. Donner la formule topologique de cet acide.
2.2.2. Entourer sur la représentation précédente les groupes caractéristiques présents dans la molécule et les nommer.
2.2. Analyse spectroscopique.
2.2.1. Parmi les spectres IR proposés dans le document 1 ci-après, choisir en justifiant celui correspondant à l’acide lactique.
2.2.2. Prévoir, en justifiant la réponse, le nombre de signaux présents dans le spectre RMN de l’acide lactique ainsi que leur
multiplicité.
Donnée : bandes d’absorption en spectroscopie IR
Liaison
CC
C=O
OH (acide
carboxylique)
CH
OH
(alcool)
Nombre d’onde
(cm1)
1000 - 1250
1700 - 1800
2500 - 3200
2800 - 3000
3200 - 3700
Document 1

Documents de Physique-Chimie – M. MORIN
3
2.3. Propriétés acido-basiques de l’acide lactique.
L’acide lactique a pour formule CH3–CHOH–COOH. Sa base conjuguée est l’ion lactate CH3–CHOH–COO–.
2.3.1. Donner la définition d’un acide selon Brönsted.
2.3.2. Ecrire l’équation de la réaction de l’acide lactique avec l’eau.
2.3.3. Dans la cellule musculaire, l’acide lactique est formé à partir de l’acide pyruvique de formule
CH3–CO–COOH. La transformation produite est une oxydoréduction faisant intervenir le couple acide pyruvique / acide lactique.
Écrire la demi-équation électronique associée au couple.
S’agit-il d’une oxydation ou d’une réduction de l’acide pyruvique dans la cellule musculaire ?
3. Variation locale du pH sanguin en l’absence des processus de maintien.
Lorsque l’acide lactique produit dans la cellule musculaire est en partie transféré dans le sang, il réagit avec les ions
hydrogénocarbonate selon l’équation :
CH3–CHOH–COOH(aq) + HCO3–(aq) CH3–CHOH–COO–(aq) + CO2,H2O(aq) (réaction 3)
Données à 37°C :
Pour le sang avant l’effort : - [HCO3-]i = 2,710-2 mol.L-1
- [CO2, H2O]i = 1,410-3 mol.L-1
- pKa (CO2, H2O / HCO3-) = pKa1 = 6,1
- pKa (acide lactique / ion lactate) = pKa2 = 3,6
On considère un volume V = 100 mL de sang « après » effort dans lequel apparaît n0 = 3,010–4 mol d’acide lactique
3.1. Exprimer la constante d’équilibre K de la réaction 3 dont l’expression est
en fonction de Ka1 et
Ka2. Calculer la valeur de K.
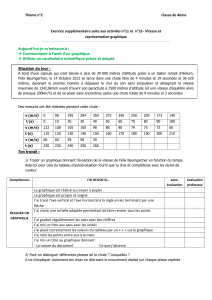
3.2. En supposant la transformation totale, compléter le tableau d’évolution des espèces (tableau d’avancement) fourni ci-
dessous (à rendre avec la copie)
3.3. Calculer alors pour le sang après effort : [HCO3–]f et [CO2, H2O]f.
3.4. En utilisant la relation établie au 1.1.a) calculer le pH local du sang après effort.
L’acide lactique est noté AH, sa base conjuguée A–
Avancement
AH(aq) + HCO3-(aq) A-(aq) + (CO2 , H2O)aq
État initial
x= 0
n (mol)
État intermédiaire
x
État final
x = xmax

Documents de Physique-Chimie – M. MORIN
4
Exercice II. Les trois records de Felix Baumgartner. 7,5 points
Le 14 octobre 2012, Félix Baumgartner a réalisé un saut historique en
inscrivant trois records à son tableau de chasse : celui de la plus haute
altitude atteinte par un homme en ballon soit 39 045 m d’altitude, le record
du plus haut saut en chute libre, et le record de vitesse en chute libre soit 1 341,9 km.h-1.
Après une ascension dans un ballon gonflé à l’hélium, il a sauté vers la Terre,
vêtu d’une combinaison spécifique en ouvrant son parachute au bout de 4 min et 20 s.
Le saut a duré en totalité 9 min et 3 s.
Ascension du ballon Il a fallu concevoir un ballon déformable gigantesque, faisant 100 m de hauteur et 130 m de diamètre
lors de son extension maximale. En raison de la diminution de la densité de l’air avec l’altitude, le volume du ballon
augmente lors de l’ascension de façon à ce que la poussée d’Archimède reste constante.
« Pour assurer une vitesse d’ascension suffisante, le volume initial d’hélium utilisé était de 5 100 mètres cubes, c’est-à-dire
le double du nécessaire pour la sustentation(1). En pratique, si l’on ajoute à la masse de l’équipage celle du ballon et de
l’hélium, c’est environ 3 tonnes qu’il a fallu soulever. »
D’après un article de « Pour la Science » janvier 2013 (1)
Sustentation : état d’un corps maintenu à faible distance au-dessus d’une surface, sans contact avec celle-ci.
Étude du saut de Felix Baumgartner La masse de Félix Baumgartner et de son équipement est m = 120 kg. La date t = 0
correspond au début du saut de Felix Baumgartner.

Documents de Physique-Chimie – M. MORIN
5
Données :
- L’expression de la poussée d’Archimède exercée par l’air sur un corps est la suivante :
avec
vecteur unitaire vertical vers le haut,
air (kg.m-3) masse volumique de l’air dans lequel est
plongé le corps, V (m3) volume du corps placé dans l’air et g intensité du champ de pesanteur ; g l’intensité du champ
de pesanteur est considérée comme constante entre le niveau de la mer et l’altitude de 39 km : g = 9,8 m.s-2 ;
- la stratosphère est la couche de l’atmosphère qui s'étend de 10 à 50 km d’altitude environ ;
- la masse volumique de la partie supérieure de la stratosphère est de l’ordre de 0,015 kg.m-3, celle de la troposphère
au niveau du sol est 1,22 kg.m-3 ;
- la célérité du son dans l’air en fonction de l’altitude est donnée dans le tableau ci-dessous :
- la vitesse d’un mobile dans un fluide est dite supersonique si elle est supérieure à la célérité du son dans ce fluide.
Partie 1 : ascension en ballon sonde de Félix Baumgartner
Le volume de l’équipage est négligeable par rapport au volume du ballon.
1.1. Indiquer la force qui est responsable de l’ascension du ballon.
1.2. Faire le bilan des forces qui s’exercent sur le système {ballon ; équipage} juste après le décollage, en négligeant les forces de
frottement. Illustrer ce bilan de forces par un schéma, sans souci d’échelle mais cohérent avec la situation physique.
1.3. En utilisant les données, les informations du texte et les connaissances acquises, vérifier par un calcul que le ballon peut
décoller.
1.4. Après quelques minutes d’ascension, le mouvement du système {ballon ; équipage} est considéré comme rectiligne uniforme.
Déterminer alors la valeur de la force de frottement de l’air.
Partie 2 : saut de Félix Baumgartner.
On étudie maintenant le système {Félix Baumgartner et son équipement} en chute verticale dans le référentiel terrestre considéré
comme galiléen. On choisit un axe (Oz) vertical vers le haut dont l’origine O est prise au niveau du sol. Le système étudié, noté S,
a une vitesse initiale nulle. On négligera la poussée d’Archimède.
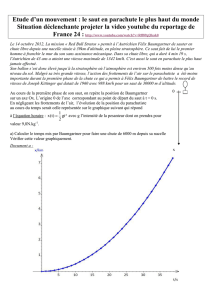
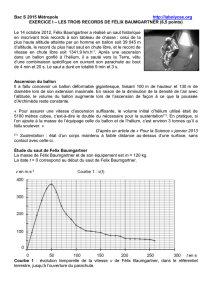
2.1. Utiliser l’étude du saut de Félix Baumgartner (courbe 1) afin de déterminer la valeur de son accélération si t < 20 s. Commenter
le résultat obtenu.
2.2. Lors de son saut, Félix Baumgartner a-t-il atteint une vitesse supersonique ? Justifier.
2.4. Les schémas ci-dessous représentent à trois instants les forces appliquées au système S lors du saut : le poids
et la force
modélisant les frottements.
Affecter un schéma à chacune des dates : t1 = 40 s, t2 = 50 s et t3 = 60 s.
2.5. Déterminer l’altitude à laquelle Félix Baumgartner ouvre son parachute. En supposant que le système a un mouvement
rectiligne et uniforme après l’ouverture du parachute et jusqu’à l’arrivée au sol, déterminer la valeur de la vitesse du système
durant cette phase du mouvement. On rappelle que le saut a duré en totalité 9 min et 3 s.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%