Exercices: La classification périodique des éléments

Chapitre 1 : La classification périodique des éléments Exercices
PCSI, Lycée de l’Essouriau 2014/2015
Exercices: La classification périodique des éléments
Exercice n°1 : Le soufre naturel:
Le soufre naturel est principalement constitué de trois isotopes : 32S, 33S et 34S. Le soufre 32 est
l'isotope le plus abondant, avec un pourcentage massique égal à 95,02 % dans le soufre naturel.
Donner la composition des noyaux des différents isotopes.
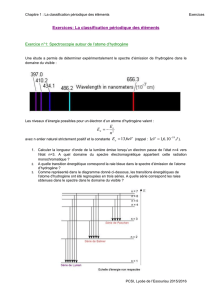
Exercice n°2 : Série de raies:
Dans le spectre d'émission de l'atome d'hydrogène, la série de Lyman est associée aux transitions d'un
niveau d'énergie n > 1 vers le niveau d'énergie n = 1.
Rappel :
eV
n
En26,13
;
JeV 19
10.6,11
1. Calculer la longueur d'onde λ3→1 associée à la transition du niveau n = 3 vers le niveau n = 1.
2. Dans la série de Lyman, à quelle transition correspond la raie de longueur d'onde maximale?
Déterminer sa valeur.
3. Dans la série de Lyman, à quelle transition correspond la raie de longueur d'onde minimale? Déterminer
sa valeur.
4. Une raie de la série de Lyman est associée à la longueur d'onde λ = 95,2 nm. À quelle transition
correspond-elle ?
Exercice n°3: Configuration électronique d'un atome:
1. Donner la configuration électronique des atomes suivants dans leur état fondamental : 8O, 12Mg,
18Ar, 20Ca, 27Co, 34Se, 40Zr, 51Sb, 76Os. On précisera quels sont les électrons de valence et on
représentera les sous-couches en cours de remplissage.
2. Le molybdène 42Mo et l’argent 47Ag présentent tous les deux une anomalie à la règle de
Klechkowsky. Écrire la configuration attendue en respectant la règle de Klechkowsky, puis
comparer à la configuration réelle (voir tableau périodique du cours).
Exercice n°4: Configuration électronique d'un ion:
1. Préciser la configuration électronique des ions suivants dans leur état fondamental : 26Fe2+ et
33As−. On précisera quels sont les électrons de valence et on représentera les sous-couches en
cours de remplissage.
2. Préciser la configuration électronique de l’ion le plus probable issu de O, Cl, Ba (Baryum), Rb
(Rubidium).

Chapitre 1 : La classification périodique des éléments Exercices
PCSI, Lycée de l’Essouriau 2014/2015
Exercice n°5: Parcourons la classification périodique:
Terminez les phrases suivantes :
1. Le début d'une période de numéro n coïncide avec celui du remplissage de la couche dont le
nombre quantique principal vaut...
2. Le remplissage des sous-couches s s'effectue dans les colonnes...
3. Le remplissage des sous-couches p s'effectue dans les colonnes...
4. Le remplissage des sous-couches d s'effectue dans les colonnes...
5. Le remplissage des sous-couches f s'effectue dans les cases... à... et... à...
6. Les niveaux s et p d'une couche de nombre quantique principal n se remplissent au cours de la
période numéro...
7. Le niveau d d'une couche de nombre quantique principal n se remplit au cours de la période de
numéro...
8. Le niveau f d'une couche de nombre quantique principal n se remplit au cours de la période de
numéro...
Exercice n°6 : Configuration électronique et place dans la classification périodique:
1. Connaissant leur configuration électronique, donner la place des éléments suivants dans la
classification périodique.
Rmq: Pour plus de commodité, on peut utiliser le symbole du gaz rare situé avant l'élément dans la
classification périodique pour décrire sa configuration électronique de cœur.
Ex: C: 1s2 2s2 2p2. Le gaz rare situé avant le carbone dans la classification périodique est
l'hélium. La configuration électronique du carbone peut donc s'écrire: [He] 2s2 2p2
a) Germanium Ge : [Ar] 4s2 3d10 4p2 ; b) Plomb Pb : [Xe] 6s2 4f14 5d10 6p2 ;
c) Phosphore P : [Ne] 3s2 3p3 ; d) Iridium Ir : [Xe] 6s2 4f14 5d7 ;
e) Rubidium Rb : [Kr] 5s1
2. Déduire le numéro atomique Z et la configuration électronique des éléments suivants connaissant
leur place dans la classification périodique. On utilisera les symboles des gaz rares pour décrire la
configuration de cœur. (Voir écriture des configurations électroniques de la question 1.)
a) Oxygène O : 2ème période, 16ème colonne ; b) Chlore Cl : 3ème période, 17ème colonne ;
c) Manganèse Mn : 4ème période, 7ème colonne ; d) Baryum Ba : 6ème période, 2ème colonne ;
e) Cadmium Cd: 5ème période, 12ème colonne.
3. Parmi tous les éléments cités, lesquels sont des éléments de transition ?

Chapitre 1 : La classification périodique des éléments Exercices
PCSI, Lycée de l’Essouriau 2014/2015
Exercice n°7 : L'élément azote:
1. Donner la configuration électronique de l’atome d’azote (Z = 7) dans son état fondamental.
2. Citer un autre élément appartenant à la même colonne du tableau périodique. Donner son numéro
atomique et sa configuration.
3. Lequel des deux éléments que vous avez choisi est le plus électronégatif ?
Exercice n°8: Evolutions de propriétés dans la classification périodique
1. Classer les éléments suivants par électronégativité croissante : F, Si, S, Cl, Ca, Mn.
On donne les rayons atomiques, en pm, des éléments de la colonne du phosphore :
Elément
N
P
As
Sb
Rayon (pm)
65
100
115
145
2. Justifier l’évolution observée.
1
/
3
100%