Cliquez-ici pour télécharger le fichier PDF de la publication.

Régulation neurologique centrale de la pression artérielle, modifications
pathologiques
Pr. Nicolas Bruder
DAR, CHU Timone, Marseille
e-mail : [email protected]
Les centres vasomoteurs sont situés dans le tronc cérébral. Ce sont ces centres qui sont
responsables de la régulation à court terme de la pression artérielle (PA). L’activité de ces
centres est sous la dépendance de réflexes dont le principal est le baroréflexe, et agissent en
modulant l’activité sympathique et parasympathique. L’activité des centres vasomoteurs
bulbaires est modifiée par des afférences encéphaliques dont l’importance n’a été reconnue
qu’assez récemment. L’objectif de cette présentation est de revoir les interactions entre les
pathologies affectant le système nerveux central et le système cardiovasculaire.
Centres vasomoteurs du tronc cérébral et baroréflexe
Centres vasomoteurs
La principale formation centrale est le centre intermediolateralis situé dans le bulbe et
comprenant les neurones sympathiques préganglionnaires. Cette structure, composée de
plusieurs noyaux, est sous la dépendance d’influx excitateurs et inhibiteurs. Une des
structures modulant l’activité sympathique est située dans la partie latérale du bulbe (rostral
ventrolateral medulla : RVLM).
Les neurones préganglionnaires parasympathiques sont situés dans 2 noyaux situés dans la
partie dorsale du bulbe : le noyau ambigu (NA) et le noyau dorsal du vague (NDV).
Les afférences provenant des barorécepteurs, des chémorécepteurs et des récepteurs
cardiaques et pulmonaires convergent vers un autre centre bulbaire : le noyau du tractus
solitaire (NTS). Les neurones situés dans le NTS transmettent des messages excitateurs ou
inhibiteurs aux neurones présympathiques de la RVLM et aux NA et NDV. Le NTS reçoit
également des afférences supraspinales provenant de l’hypothalamus, lui-même largement
relié aux neurones corticaux. Bien que les mécanismes précis chez l’homme de l’influence
des hémisphères cérébraux sur la régulation de la pression artérielle soient imparfaitement
connus, nous verrons plus loin que ceux-ci jouent un rôle important en pathologie pour
expliquer les désordres cardio-vasculaires des atteintes neurologiques centrales.

Baroréflexe
Le baroréflexe est le principal mécanisme de régulation à court terme de la PA. On distingue
un système à haute pression dont les récepteurs sont situés au niveau de la crosse aortique ou
du sinus carotidien et un système à basse pression dont les récepteurs sont situés au niveau de
l’oreillette droite et des vaisseaux pulmonaires. Ces barorécepteurs sont sensibles à
l’étirement et envoient des influx inhibiteurs au NTS par l’intermédiaires des nerfs crâniens
IX et X. En dessous de 60 mm Hg de PA, aucun influx ne peut être détecté. La stimulation
des barorécepteurs augmente progressivement au-dessus de ce niveau pour devenir maximale
autour de 180 mm Hg. L’arrivée de ces influx au niveau du NTS entraîne une inhibition des
neurones situés dans la RVLM et donc une diminution du tonus sympathique, et une
stimulation des centres parasympathiques. Ce système permet donc une adaptation
permanente et rapide du tonus sympathique et parasympathique lors des modifications de la
PA. Le ganglion stellaire est un relais important de l’arc baroréflexe. Son blocage par un
anesthésique local (qui peut survenir lors d’un bloc cervical) provoque une tachycardie qui est
liée à une augmentation de l’activité sympathique (puisque le baroréflexe est un système
inhibiteur)[1]. En physiologie, il existe une puissante activité inhibitrice permanente du
baroréflexe. Ceci explique que le blocage cervical du nerf glosso-pharyngien (IX) et du vague
(X) chez le volontaire sain provoque une poussée hypertensive et une tachycardie liées à une
augmentation importante de l’activité sympathique[2]. Ceci pourrait également expliquer en
partie les troubles dysautonomiques survenant dans les syndromes de Guillain-Barré graves.
L’activité du système nerveux autonome peut être évaluée de plusieurs manières :
- par des tests cliniques simples mais peu spécifiques comme la variabilité de la
fréquence cardiaque lors d’une manœuvre de Valsalva
- la mesure des catécholamines plasmatiques ou urinaires (adrénaline, noradrénaline,
dérivés méthoxylés) qui est une méthode assez grossière. Des mesures beaucoup
plus sensibles de turn-over de la noradrénaline qui nécessitent l’utilisation
d’isotopes radioactifs
- la mesure de l’activité nerveuse sympathique musculaire périphérique par
microélectroneurographie qui est la technique de référence
- La mesure de la variabilité de la fréquence cardiaque ou de la pression artérielle
qui s’est particulièrement développée en anesthésie pour évaluer la profondeur de
l’anesthésie. L’idée est que plus l’anesthésie est profonde plus le système nerveux
autonome est inhibé moins la variabilité est importante.

Contrôle encéphalique de la pression artérielle
Le fait que des atteintes situées au dessus du tronc cérébral puissent provoquer des troubles
cardiovasculaires sévères est connu de longue date. Dès 1929, Penfield décrivait un syndrome
de « convulsions diencéphaliques » (diencephalic seizures). Ce syndrome associe différentes
manifestations de troubles neuro-végétatifs sévères, dont une tachycardie et une hypertension
sévères, dont la survenue brutale et la durée brève ont fait penser dans un premier temps à une
origine épileptique. En réalité, des manifestations d’épilepsie n’ont jamais pu être démontrées
dans la genèse de ce syndrome régulièrement observé dans les hémorragies profondes
diencéphaliques ou au cours des traumatismes crâniens graves[3]. Plus simplement, les
relations entre les émotions (peur, douleur, angoisse …) et le système cardio-vasculaire sont
connues depuis des siècles. Les questions qui se posent toujours sont la localisation
anatomique précise de ces centres encéphaliques du contrôle cardiovasculaire et les
implications cliniques en pathologie.
Structures encéphaliques de contrôle cardio-vasculaire
Les principales structures encéphaliques identifiées pour le contrôle du système nerveux
autonome sont le système limbique et en particulier l’amygdale, et l’insula. La partie médiane
et ventrale du lobe temporale, le cortex temporal et le cortex préfrontal sont également des
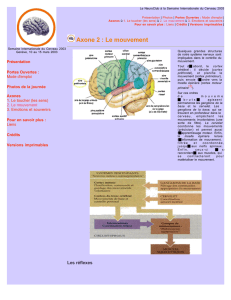
zones qui pourraient jouer un rôle (figure 1).
L’amygdale joue un rôle important dans l’expression des comportements émotionnels et
intègre les réponses végétatives des stimuli émotionnels comme la peur et l’anxiété. Elle est
composée de plusieurs noyaux (médian, central, latérobasal). Ces noyaux ont des connexions
réciproques avec les zones gérant les émotions : lobe frontal et temporal, gyrus cingulaire.
L’amygdale reçoit également des afférences du thalamus et de l’hypothalamus et des zones du
tronc cérébral impliquées dans la régulation cardio-vasculaire. L’amygdale, principalement le
noyau central, envoie des efférences vers l’hypothalamus et le tronc cérébral (noyau du
tractus solitaire, noyau moteur dorsal du vague), alors que les deux autres noyaux ont pour
rôle principal l’intégration des réponses végétatives aux stimuli émotionnels[4].

Figure 1 : L’injection de virus
rabique au niveau des terminaisons
sympathiques chez le rat permet de
retrouver des lésions au niveau du
complexe amygdalien, du cortex
insulaire, de la partie médiane et
ventrale du lobe temporale, du cortex
temporal, du cortex préfrontal
médian, qui sont aussi des zones
impliquées dans la genèse des
émotions chez l’homme. Il existe
donc clairement une relation
anatomique entre le système
sympathique et les hémisphères
cérébraux (MJ Westerhaus, AD
Loewy Brain Research, 2001, 117-
127)
Le cortex insulaire est le deuxième site encéphalique le plus impliqué dans le contrôle cardio-
vasculaire[5]. Chez l’homme, la stimulation de l’insula du côté droit augmente la fréquence
cardiaque et la PA, alors que la stimulation du côté gauche ne provoque qu’une bradycardie.
De manière similaire, lors d’un test de Wada, l’injection de barbiturique du côté droit diminue
la fréquence cardiaque alors que l’injection du côté gauche l’augmente. L’imagerie IRM
fonctionnelle a également montré que la stimulation des barorécepteurs augmente l’activité
fonctionnelle des neurones de l’insula, généralement du côté droit[6]. Il apparaît donc que le
cortex insulaire postérieur gauche est impliqué principalement dans l’intégration de l’activité
parasympathique cardiaque. Le cortex insulaire postérieur droit est impliqué dans la
régulation sympathique à la fois vasculaire et cardiaque. Mais des connexions
interhémisphériques entres les régions de l’insula impliquées dans le contrôle cardio-
vasculaire ont été trouvées chez le rat[7]. Des circuits à la fois excitateurs et inhibiteurs entre
l’insula et l’aire hypothalamique latérale ont été identifiés. Ces zones hypothalamiques se
projettent vers le tronc cérébral et la moelle. Il est donc clair que tout changement dans la
balance de ces influx inhibiteurs et excitateurs (anesthésie, accident vasculaire, épilepsie, …)
s’accompagne de modifications cardio-vasculaires.
Il existe des relations directes et indirectes entre l’amygdale et l’insula. Il existe des afférences
du noyau latéro-basal de l’amygdale vers l’insula et en retour des afférences de l’insula vers
les noyaux latéro-basal et central de l’amygdale. Le noyau dorso-médian du thalamus reçoit

des afférences du noyau central de l’amygdale et se projette vers le cortex insulaire, assurant
une connexion indirecte entre les 2 structures.
Atteintes neurologiques et système cardio-vasculaire
Un bloc nerveux cervical par des anesthésiques locaux ou une neuropathie périphérique
atteignant les paires crâniennes IX et X augmente l’activité sympathique en inhibant l’activité
baroréflexe[2]. Au repos, une activité sympathique basse repose sur une forte inhibition par le
baroréflexe. Il est également bien connu que les atteintes du tronc cérébral ou de
l’hypothalamus ou la neurochirurgie dans ces régions, peuvent s’accompagner de troubles
cardio-vasculaires majeurs.
L’hémorragie sous-arachnoïdienne (HSA) par rupture d’anévrysme est la pathologie qui a
donné lieu au plus grand nombre de travaux sur les interactions entre une pathologie
encéphalique et les désordres cardio-vasculaires. Ces modifications peuvent être dans un
premier temps liées à l’hypertension intracrânienne aiguë qui accompagne toujours la rupture
anévrysmale (figure 2).
Figure 2 : resaignement
anévrysmal avant
l’intervention chirurgical
chez une patiente
hospitalisée en réanimation.
L’HIC très sévère
contemporaine de cette
hémorragie (maximum 60
mm Hg) provoque une
asystolie suivie d’un rythme
d’échappement jonctionnel.
Les modifications de l’ECG sont très fréquentes après HSA. Ces troubles sont attribués à la
stimulation sympathique intense qui accompagne la rupture anévrysmale et l’hypertension
intracrânienne. Celle-ci favorise l’apparition de troubles du rythme, surtout à craindre
lorsqu’il existe un allongement important de l’espace QT. Ces modifications concernent
principalement la repolarisation (sus- ou sous décalage du segment ST, augmentation de
l’espace QT, inversion de l’onde T)[8-10]. Elles sont d’autant plus fréquentes que
l’hémorragie est abondante[11] mais les modifications de l’ECG ne sont pas un facteur
indépendant du pronostic[12]. Il existe un problème clinique lorsque ces anomalies sont
associées à des troubles de la fonction myocardique avec parfois augmentation des enzymes
 6
6
 7
7
 8
8
1
/
8
100%