Organomagnésiens : Chimie, Préparation et Réactivité

organomagnésiens - chimie.
1
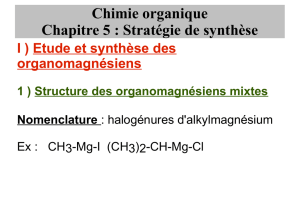
PRÉSENTATION
organomagnésiens, composés organiques synthétiques contenant au moins une liaison chimique carbone-magnésium. Ce sont des organométalliques — composés présentant au moins une liaison carbone-métal. Les organomagnésiens symétriques,
de formule brute R2Mg, avec R radical alkyle (R = CnH2n+1, n étant un entier), sont généralement moins réactifs que les organomagnésiens mixtes, dont la formule brute simplifiée est R-MgX, dans laquelle X est un halogène (en fait, les
organomagnésiens mixtes sont souvent solvatés). Par exemple, le composé de formule C2H5MgBr est le bromure d’éthyl-magnésium. Les organomagnésiens mixtes ont été découverts en 1901 par Grignard. C’est pourquoi on les appelle parfois
réactifs de Grignard. Notons que leur structure exacte est encore discutée à ce jour et fait l’objet de recherches pointues.
2
PRÉPARATION
2.1
Bilan de la réaction
On obtient un organomagnésien en traitant du magnésium métallique par un halogénoalcane (de formule RX, avec R groupement alkyle et X atome d’halogène), dans un solvant anhydre, comme l’éther absolu ou le tétrahydrofurane, et dans une
verrerie sèche. La réaction a pour bilan :
2.2
Caractéristiques
La facilité de synthèse d’un organomagnésien mixte dépend de la nature du groupement alkyle et de l’halogène (dans l’halogénoalcane), ainsi que du solvant. Par exemple, certains chloroalcanes (RCl) réagissent difficilement. Dans ce cas, il est
nécessaire d’utiliser un magnésium activé, par exemple avec des paillettes d’iode. Les composés organiques contenant plusieurs atomes d’halogène réagissent souvent de manière complexe avec le magnésium. En effet, on assiste alors fréquemment
à l’élimination de l’un des atomes d’halogène et à des réactions de duplication. En fait, on emploie le plus souvent les bromoalcanes (RBr), avec lesquels la synthèse est la plus facile. On considère en général que le solvant entre dans la composition
du réactif et qu’il n’a donc pas uniquement une fonction de solvant. Précisons enfin que la synthèse des organomagnésiens s’effectue dans un milieu rigoureusement anhydre, car ils réagissent violemment avec l’eau en se décomposant.
3
RÉACTIVITÉ DES ORGANOMAGNÉSIENS
La réactivité des organomagnésiens se résume à l’écriture suivante :
En effet, la partie alkyle R du composé est ici nucléophile car sa densité électronique est supérieure à celle du magnésium (métal électropositif). Ainsi, les organomagnésiens peuvent intervenir dans des substitutions nucléophiles et des additions
nucléophiles.
3.1
Substitutions nucléophiles
Les organomagnésiens réagissent avec deux types de composés. Les premiers sont les composés à hydrogène mobile (AH), comme l’eau, les acides organiques, les alcools, les phénols ou les amines secondaires. La réaction entre un
organomagnésien et l’un de ces composés conduit à la formation de l’hydrocarbure RH et du composé AMgX, selon : RMgX + AH → RH + AMgX
Les seconds réactifs employés sont les composés à halogène mobile (AX). La réaction a alors pour bilan : RMgX + AX → RA + MgX2
Si A est un métal, RA est un dérivé organométallique ; si A est un non-métal, RA est un dérivé organo-non-métallique ; si A est un radical alkyle, RA est un hydrocarbure. De nombreux halogénures métalliques, comme le bromure d’argent, tendent à
provoquer une réaction de duplication. Dans certains cas, un halogène fixé sur un carbone peut être assez acide pour réagir avec un organomagnésien. Ces réactions permettent d’obtenir de nouveaux types de magnésiens qui ne peuvent être
synthétisés par les méthodes habituelles.
3.2
Additions nucléophiles
Les réactions d’addition sont les plus importantes : les organomagnésiens réagissent avec les composés organiques pour donner des produits contenant une nouvelle liaison carbone-carbone. Par exemple, l’action à basse température de l’anhydride
carbonique sur un réactif de Grignard conduit à la formation d’un sel d’acide carboxylique à partir duquel on peut facilement obtenir l’acide libre :
L’addition d’un organomagnésien sur le groupe carbonyle de nombreux aldéhydes et cétones mène à la formation d’un alcool primaire, secondaire ou tertiaire. Les organomagnésiens réagissent avec l’oxyde d’éthylène par ouverture du pont
époxydique pour donner un alcool. La chaîne carbonée est ainsi allongée et l’alcool obtenu peut être transformé en halogénure correspondant, le processus pouvant être renouvelé :

3.3
Autres réactions
Lorsque le groupe carbonyle est stériquement encombré, les organomagnésiens peuvent agir comme réducteurs. Avec les esters, ils produisent tout d’abord une cétone, puis la réaction se poursuit entre une molécule d’organomagnésien et une
molécule de cétone pour former un alcool tertiaire. Notons que les chlorures et les anhydrides réagissent de manière analogue en produisant des alcools tertiaires. Si l’on expose un halogénure d’alcoylmagnésium à l’oxygène, ou plus généralement à
l’air, il s’oxyde en alcoolate. Par hydrolyse, l’acoolate produit ensuite l’alcool correspondant à l’halogénure. Les organomagnésiens peuvent réagir avec de nombreux composés contenant de l’azote ou du soufre, comme les imines, les nitriles et les
sulfoxydes. De plus, la réaction d’un organomagnésien avec les halogénures de bore, de phosphore, de silicium et d’étain permet de synthétiser assez facilement les composés organométalliques de ces éléments. On prépare, par exemple, le
tétraphénylsilane par réaction du bromure de phénylmagnésium, un organomagnésien, avec le tétrachlorure de silicium, selon : 4C6H5MgBr + SiCl4 → (C6H5)4Si + 4MgBrCl
4
UTILISATIONS
Comme de nombreux composés organométalliques, tels que les organolithiens (R-Li) ou les organozinciques (R2Zn), les organomagnésiens sont des intermédiaires de synthèse qui permettent de préparer un grand nombre de composés organiques.
Ils sont notamment utilisés dans les laboratoires de chimie et dans certaines industries fabriquant des volumes peu élevés de produits, en particulier dans l’industrie pharmaceutique.
Voir aussi magnésium ; métaux ; réaction chimique.
Microsoft ® Encarta ® 2009. © 1993-2008 Microsoft Corporation. Tous droits réservés.
1
/
2
100%