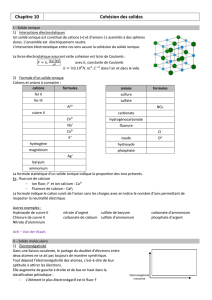
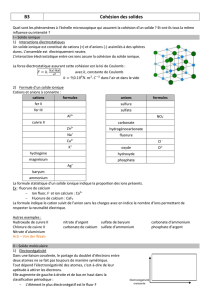
Activité : Composés ioniques et moléculaires

chapitre 11 : cohésion et activité
dissolution (p174 à 195)
i. propriétés électriques des molécules
1. Interaction entre un objet électrisé et un liquide :
Expérience 1 :
Faire couler un mince filet d’eau du robinet.
Électriser la baguette de PVC
Approcher l’éprouvette du filet d’eau.
Réaliser la même expérience avec du cyclohexane
2. Interprétation :
a) Les molécules mises en jeu :
L’eau
Donner la formule de Lewis de l’eau. (Z(O) = 8 ; Z(H) = 1) ………………………………………………………
Combien y-a-t-il de doublets non liants dans cette molécule ?.......................................................................
Rappeler la géométrie de la molécule d’eau………………………………………………
Le cyclohexane
On donne la formule développée du cyclohexane ci-contre :
Donner sa formule topologique.
b) L’électronégativité :
L’électronégativité d’un élément chimique est sa capacité à attirer les électrons partagés de la
liaison covalente avec un autre élément. Elle est désignée par la lettre grecque khi
Le tableau ci-dessous montre les valeurs des
électronégativités de certains éléments chimiques.
Relever dans le tableau les électronégativités
des éléments suivants :
- l’hydrogène = - le carbone =
- l’oxygène = - le chlore =
c) Molécule polaire :
Lorsqu’une liaison covalente s’établit entre deux atomes dont la différence d’électronégativité est
grande, on dit que la liaison est …………….
La liaison H – H est-elle polarisée ? ……………………………………………………………..
Quand une liaison chimique est polarisée, on dit que :
- l’atome le plus électronégatif porte une charge électrique partielle négative notée : –
- l’atome le moins électronégatif porte une charge électrique partielle positive notée : +
Par exemple Justifier le signe des charges partielles :
……………………………………………………………………………
Revenons à la molécule d’eau
La liaison H – O est-elle polarisée ? …………………………………..
Si oui, l’annoter en respectant les règles de notation précédentes.
Dans la molécule d’eau ci-contre, représenter les charges
partielles des atomes

On dit qu’une molécule est ………….. quand le centre géométrique G+ des charges partielles positives
n’est pas confondu avec le centre géométrique des charges partielles G- négatives.
La molécule d’eau est-elle polaire ? ………………………………………………..
La molécule de cyclohexane est-elle polaire ?
……………………………………………………………………
……………………………………………………………………
Justifier les observations de l’expérience 1 :
………………………………………………......................................................
.......................................................................................................................
Bilan
II. cohésion des composés ioniques
1) Cristal ionique :
Le chlorure de sodium NaCl (sel de table) est un cristal ionique : c’est un assemblage
d’ions sodium Na+ et d’ions chlorure Cl–.
Le cristal ionique NaCl est constitué d’un empilement régulier de …….….
élémentaires au sein desquels chaque ……………….. est entouré d’ions porteurs
d’une charge ….............. Les ions sont disposés de façon …………. dans le cristal.
2) Loi de Coulomb :
En raison de l’interaction électrique deux corps
porteurs de charge électrique
- de mêmes signes se ……………………
- de signes contraires s’…………………..
3) Interprétation de la stabilité du cristal :
Expliquer alors la cohésion (c’est à dire l’immobilité) des ions dans le
cristal ionique.
………………………………………..............................................................
....................................................................................................................
4) Dissolution d’un solide ionique : le chlorure de sodium NaCl
Visionner l’animation suivante :
Quel atome de la molécule d’eau attire les cations
sodium du cristal de sel ?
…………………………………………….
Quel(s) atome(s) de la molécule d’eau attire les anions
chlorure du cristal de sel ?
………………………………….
Compléter alors le schéma ci-contre en faisant
apparaitre les différentes charges électriques :
Ecrire alors l’équation
de cette dissolution :

5) Exemple
On dissout une quantité de matière n de sulfate de sodium Na2SO4 dans un volume V de solution aqueuse.
Ecrire l’équation chimique de cette dissolution :
Comparer les concentrations des ions et du solide ionique.
III. cohésion des composés moléculaires
1) Liaisons de Van der Waals :
Le nuage électronique d’une molécule est l’ensemble de tous les électrons périphériques des atomes
constituant cette molécule.
La cohésion entre molécules provient d’interactions électrostatiques entre les nuages électroniques,
appelées interactions de Van der Waals.
Les interactions de Van der Waals assurent la cohésion des solides et des liquides moléculaires.
Elles interviennent dans une moindre mesure dans les gaz, car les molécules qui les composent sont trop
éloignées les unes des autres. Ces interactions
sont beaucoup plus faibles que les interactions
de nature électrostatique qui s’exercent entre
les ions dans un solide ionique. Il n’y a pas de
transfert d’électrons entre les molécules, celles-
ci restant électriquement neutres.
2) Liaisons hydrogène :
Les liaisons hydrogène sont des liaisons intermoléculaires qui ne
s’établissent qu’entre certaines molécules et qui implique toujours un
atome d’hydrogène.
Elles sont vingt fois moins solides que les liaisons covalentes, et elles
sont dix fois plus solides que les liaisons de Van der Waals.
a. Faire apparaître sur le schéma ci-contre les liaisons hydrogène
b. Expliquer le terme « liaisons intermoléculaires
»…………………………………………………………………………….
c. Les liaisons covalentes peuvent-elles être qualifiées ainsi ?
……………………………………………………………………………….
3) Dissolution d’un composé moléculaire : le chlorure d’hydrogène HCl
La vidéo suivante présente l’expérience dite du
« jet d’eau » c'est-à-dire la dissolution du chlore
d’hydrogène HCl dans l’eau H2O
a. Rappeler le schéma de Lewis de la
molécule d’eau.
b. Montrer si cette molécule est polaire.
c. Rappeler le schéma de Lewis de la
molécule de chlorure d’hydrogène
d. Montrer si cette molécule est polaire.
e. Expliquer alors pourquoi la molécule de
chlorure d’hydrogène est soluble dans
l’eau ?
f. Ecrire alors l’équation de dissolution
dans l’eau, de ce composé moléculaire.
Molécules d’eau liées entre elles
par des liaisons hydrogène.
1
/
3
100%