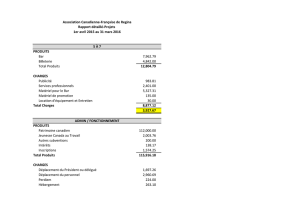
Corrigé du DM 4

m v =V
m
P
v
485 K
373 K
I
F
1 bar
20 bars
0,0998
L V
xVf=vI−vLf
vVF −vLF = 5,81.10−2
m=V
vI
= 10g
∆h=xVfhVf+ (1 −xVf)hLf−hVI =
∆U = m(∆h)−(pF−PI)V = −20,6 kJ
Q = ∆U
∆S = m(xVfsVf+ (1 −xVf)sLf−sVI) = −47J.K−1
Se=Q
T0
=−55,3J.K−1
Sc= ∆S −Se= 8,3J.K−1

∆h=q+wu
1→2qf=h2−h1
2→3wu=h3−h2
3→4qc=h4−h3
Pcd Pev
Pev = 0,85 Pcond = 10
Pev
◦
→3
Pcd
◦
4→1
Pev
•Pev = 0,85
•Pcd = 10
•Pcd
Pev
= 12
•x1= 0,35
•qF= 145 kJ.kg−1
•qc=−200 kJ.kg−1
•wu= 55 kJ.kg−1

•e=qF
wu
= 2,6
•ec=TF
Tc−TF
= 3,5
e < ec
v= 0,0125m3.kg−1m= V/v =
m
◦
x < 0,2
(P, h)
T≈ −40◦Cx≈0,5
1
/
3
100%