n°5 - CNRS

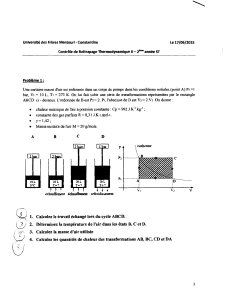
1
CONCOURS EXTERNES IT 2011
ÉPREUVE TECHNIQUE D’ADMISSION
Durée : 2 heures
Coefficient : 2
CONCOURS N° 227
Corps : Assistants Ingénieurs BAP : B
Emploi – type : Assistant en techniques d’analyse chimique
Délégation organisatrice : Bretagne – Pays de la Loire
Seul l'usage de la calculatrice non programmable est autorisé.
Toutes les réponses doivent être portées sur la copie d’examen (excepté la question n°3 de l’exercice
intitulé « Sécurité »)
Ce document est composé de 5 pages (y compris celle-ci).
Il sera tenu compte de la présentation et de l’orthographe.

2
CHROMATOGRAPHIE (30 minutes)
Question 1 : Quels sont les principaux intérêts de la CCM ?
Question 2 : Quelles sont les principales différences entre CPG et HPLC ?
Question 3
Un mélange de trois composés volatils A, B et C est analysé par CPG sur une colonne de 50 m de
longueur. Les données concernant les temps de rétention, les largeurs des pics à leur base ainsi que
les coefficients de réponse relatifs sont indiqués dans le tableau ci-dessous. Dans les mêmes
conditions, un composé ne présentant aucune affinité pour la colonne est élué avec un temps de 2.3
min.
Produit tR (min) (min) Aire Coefficient de
réponse relatif
A 9.55 0.81 21060 1.00
B 10.20 1.05 29940 1.08
C 12.45 1.15 35850 1.20
1- Calculez le coefficient de rétention pour chacun des trois produits.
2- Calculez l’efficacité de la colonne dans les trois cas.
3- Calculez la hauteur équivalente à un plateau théorique pour les trois composés.
4- En vous basant sur les dérivés B et C, déterminez le facteur de résolution de la colonne.
5- Calculez le pourcentage de chacun des composés dans le mélange.
Présentez vos résultats sous forme d’un tableau.
Question 4
Le suivi d’une réaction de nitrification / dénitrification est réalisé par HPLC. Les anions nitrites,
nitrates mais également fluorures, hydrogénophosphates, sulfates, et chlorures ont été mis en
évidence.
1- Indiquez les formules des anions.
2- Sur quel principe chromatographique vous reposeriez-vous pour analyser ces ions.
3- A quoi correspond le premier pic (tR= 1.09 min) ? (cf graphique page suivante)
4- Sur quel(s) critère(s) structural (aux) les anions peuvent-ils être séparés ? En déduire un ordre
d’élution.

3
SPECTROMETRIE D'ABSORPTION UV-VISIBLE (20 minutes)
Question 1
Réaliser le schéma de fonctionnement d’un spectromètre d’absorption UV Visible
Question 2
Une eau polluée contient du chrome (M= 52 g.mol-1) à la concentration massique d'environ 0,1 ppm.
On choisit, pour son dosage, le complexe CrIV avec le diphénylcarbazide ( = 540 nm, max= 41 700
L.mol-1.cm-1).
Déterminer la valeur du trajet optique de la cuve pour que l'absorbance A soit de l'ordre de 0,40.
Question 3
Une solution aqueuse de permanganate de potassium (c= 1,28.10-4 mol.L-1) a une transmittance T de
0,5 à 525 nm, si on utilise une cuve de 10 mm de parcours optique.
1- calculer le coefficient d'absorption molaire du permanganate pour cette longueur d’onde.
2- Si on double la concentration, calculer l'absorbance et la transmittance de la nouvelle solution.
FLUORESCENCE X (20 minutes)
Question 1: Généralités
1- Pourquoi le tableau des raies d'émission de fluorescence X ne commence t'il qu'au Lithium ?
2- Pour doser les éléments dont l'énergie du rayonnement émis est inférieure à 3 keV, il est
nécessaire de purger l'air de l'appareil pour le remplacer par de l’hélium. Pourquoi ?

4
Question 2 : Etude d'un échantillon par fluorescence X
Les rayons X produits par la source primaire sont envoyés sur un échantillon métallique. Ils peuvent
être absorbés par les atomes présents. Dans ce cas, un électron de la couche K peut être expulsé de
l'atome. L'atome ionisé émet alors, au cours de sa désexcitation, des raies de fluorescence X.
Données : h = 6,62 10-34 J.s-1 ; c = 3,00 x 108 m.s-1 ; e = 1,60 x 10-19 C
Quelle condition doit relier l'énergie du niveau K d'un atome et la longueur d'onde incidente
minimum pour qu'il y ait fluorescence X ? (mini = 1,40 10-10 m)
SECURITE (20 minutes)
Question 1: Le triangle du feu est la représentation théorique d’un incendie.
1- Donnez les trois éléments le constituant.
2- Donnez un exemple pour mettre fin à un feu pour chacun de ces 3 éléments.
Question 2
Comment réaliser en toute sécurité la dilution d'un acide fort dans de l'eau et pourquoi ?
Question 3 - Donnez la signification des pictogrammes suivants (répondre directement sur le sujet) :
Question 4 - Donnez la définition de l’acronyme A.C.M.O., et ses missions (en citer au moins 2)
Question 5 - Donnez la définition de l’acronyme E.P.I. En citer au moins deux.

5
EPREUVE D’ANGLAIS (20 minutes)
The selective oxidation of methanol to dimethoxymethane (DMM) over sulfated vanadia-titania catalysts,
prepared by co-precipitation and calcined at different temperatures, was studied in the 393-473K interval
under steady state conditions. The catalysts were characterized by X-Ray diffraction (XRD), Brunauer-
Emett-Teller isotherms (BET), inductively coupled plasma optical emission spectroscopy (ICP-OES), X-ray
photoelectron spectroscopy (XPS), scanning electron microscopy (SEM), transmission electron microscopy
(TEM), Fourier transform infrared spectroscopy (FTIR) and Raman spectroscopy. The redox and acidic
properties were examined using temperature programmed reduction (TPR), isopropanol probe reaction,
ammonia adsorption calorimetry, and pyridine adsorption FTIR techniques. As evidenced by pyridine
adsorption FTIR, some Brönsted acid sites transformed to Lewis sites upon removal of sulfate species by
washing the samples with deionized water. A high sulfur content increased the number of Brönsted acid
sites but reduced their strength. The best catalyst revealed the presence of amorphous polymeric VOx
species with terminal V=O bonds, and both redox and Brönsted acid sites, resulting from an adequate
balance between the calcinations temperature and the sulfate concentration. These are the key parameters
for optimizing the DMM production.
Question 1 : Quels sont les paramètres clés pour optimiser la production du dimethoxymethane ?
Question 2 : Comment mettre en évidence la transformation des sites acides de Brönsted en sites
acides de Lewis ?
Question 3 : La calorimétrie peut-elle être utilisée dans cette étude ? Justifiez votre réponse.
1
/
5
100%