Concours de Réorientation universitaire Session 2013

REPUBLIQUE TUNISIENNE
Ministère de l'Enseignement Supérieur
et de la Recherche Scientifique
Université de Carthage
Concours de Réorientation universitaire
Session 2013
Epreuve des Sciences physiques
., L'épreuve comporte deux exercices de chimie et deux exercices de physique.
, Le candidat est appelé à traiter un seul exercice de chimie, au choix, et les
deux exercices de physique.
, Les deux parties de physique et de chimie doivent être rédigées sur des feuilles
séparées.
, Barème: Chimie 6 points et physique 14 points (9+ 5).
Chimie
Exercice 1 ( 6 points)
On désire galvaniser une plaque P, en fer, pour cela, on réalise l'électrolyse d'une solution
aqueuse
(5)
de sulfate de nickel. La plaque P, constitue l'une des deux électrodes de
l'électrolyseur qui contient la solution
(5),
L'autre électrode est une plaque P, inattaquable,
Un générateur de tension, de force électromotrice E, est branché aux bornes de
l'électrolyseur àtravers P, et P,. La solution 5 est préparée par dissolution d'une masse m
de sulfate de nickel dans de l'eau pure de façon àobtenir une solution aqueuse de volume
V
=
0,5 L et de concentration molaire C
=
0,10 mol.V'.
1-
0-
déterminer la quantité de matière du sulfate de nickel utilisé pour préparer S,
b- En déduire la valeur de la masse m du sulfate de nickel utilisé,
2- Au niveau de la plaque P, et durant l'expérience, on note le dégagement de dioxygène,
tandis que la plaque P, se recouvre, petit à petit, par une couche fine de nickel Ni
a- Ecrire l'équation de la transformation chimique qui se produit au niveau de P"
b- Donner le schéma du montage en précisant les polarités du générateur.
c- Préciser, en le justifiant, laquelle des deux plaques P, et P, est l'anode?
3- Après une durée d'électrolyse, la concentration de 5 en ions Ni" est de 0,04 mol.L-
1
0-
Justifier la diminution de la concentration de 5 en ions Ni",
b- Calculer la masse m' du nickel déposé sur la plaque P"
c- Déterminer la quantité de matière n(O,) de dioxygène dégagé, sachant que
d'après l'équation bilan de cette électrolyse on a toujours: n(Ni)
=
2n(O,).
NB : On supposera que le volume de la solution reste constant durant toute l'électrolyse,
On donne: M(NiSO.)
=
155 g,mol'l, M( Ni )
=
59 g,mol'
l,
1/5

Exercice 2 ( 6 points)
Une lame de cuivre, plongée dans une solution aqueuse de sulfate de cuivre de
concentration Cl, constitue la demi-pile A d'une pile électrochimique P. La demi-pile B de
cette pile électrochimique est constituée d'une lame de nickel plongée dans une solution
aqueuse de chlorure de nickel de concentration Cl. Les deux demi-piles A et B sont reliées
par un pont salin.
La force électromotrice standard Eode cette pile est égale à0,57 V.
Le symbole de cette pile est:
Ni
INi
2
'(c
l)
Il
CU
2
'(C
I)
ICu,
1- Représenter le schéma de cette pile.
'J.r .",
2- Ecrire l'équation chimique associée à cette pile.
3-0-
Donner l'expression de la force électromotrice initiale E de P en fonction de Eoet
des concentrations C, et Cl.
b- Calculer la valeur de E pour
C,
=
10'l
mol.L" et
C,
=
la"
moI.L".
4- Ecrire, en le justifiant, l'équation de la réaction possible spontanément.
5-a- Calculer la valeur de la constante d'équilibre K associée à cette pile.
b- Déterminer les concentrations finales
C,
et
C,
des solutions aqueuses des deux
demi-piles A et B, lorsque la pile ne débite plus.
On supposera que les volumes des solutions, dans les deux compartiments de la pile, sont
égaux et qu'ils restent constants durant toute l'expérience.
Physique
(14
points)
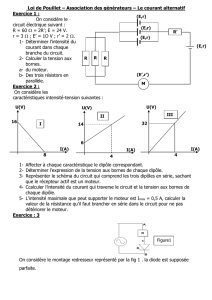
Exercice 1 (9 points)
Un dipôle PN est constitué d'une bobine d'inductance L et
de résistance r en série avec un conducteur ohmique de
résistance R
=
50 n. Un générateur de tension de force
électromotrice E est branché aux bornes du dipôle PN.
Un interrupteur k assure la fermeture du circuit. Le
schéma du montage est donné par figure 1. Un dispositif
d'acquisition permet d'enregistrer simultanément
l'évolution des tensions aux bornes de la bobine et aux
bornes du conducteur ohmique. A un instant t
=
a
s, on
ferme le circuit ainsi constitué. Les courbes C, et Clde la
figure 2 de la feuille annexe de la page 5/5, obtenues
à partir du dispositif d'acquisition, représentent
l'évolution des tensions uPQ(t) et UQN(t). Figure 1
P
(L,r)
Q
R
N
A
-1- Donner l'expression de uPQ(t) en fonction de L,r et de l'intensité du courant i(t).
2/5

2- Montrer, por application de la loi des mailles, que l'équation différentielle qui traduit
l'évolution de l'intensité i(t) du courant qui circule dans le circuit peut se mettre sous la
di 1. E L
forme: -
"-1
= -,
avec
1:
= --.
dt
1:
L R.•
r
3-a- Vérifier que: i( t )
=
ra
[1-
exp( -~ )] est solution de cette équation différentielle,
en précisant l'expression de
ID.
b- Montrer que
ID
est l'intensité du courant électrique qui traverse le circuit en régime
permanent.
B-
Par exploitation des courbes de la figure 2 de la feuille annexe de la page 5/5 :
1-
Préciser, parmi les courbes Cl et C"~celle qui correspond à l'évolution de UQN(t).
2-Justifier que la bobine a une résistance r non nulle.
3- Déterminer la valeur de l'intensité du courant qui circule dans le circuit en régime
permanent.
4- En déduire la valeur de la résistance r de la bobine et celle la force électromotrice E.
5-a-Déterminer, graphiquement, la valeur de la constante de temps
1:
du dipôle RL.
b-Déduire la valeur de l'inductance L de la bobine.
c-
Le dipôle PN précédent est associé en série à un condensateur de capacité C. Un
générateur basse fréquence(GBF) délivrant une tension sinusoïdale u(t) = U
m
sin(21TNt) est
branché aux bornes du dipôle RLC. Ala fermeture du circuit, un courant sinusoldal
d'intensité i(t)= I
m
sin(21TNt .•
4l)
s'établit. Un oscilloscope convenablement branché permet
de visualiser, simultanément, les tensions: u.(t) aux bornes du conducteur ohmique et u(t)
aux bornes du générateur. Pour une fréquence N du générateur, on obtient les
chronogrammes de la figure 3.
1-
Justifier qu'il s'agit d'un régime d'oscillations forcées, en précisant l'excitateur et le
résonateur.
2- Montrer que la courbe
C
z
de la figure 3 correspond à l'évolution de u.(t).
3- Par exploitation des chronogrammes de la figure 3 :
a- Déterminer la valeur de la fréquence N et celle de la pulsation ru.
b- Déterminer la valeur de la phase initiale
4l
et de l'intensité maximale Imdu courant.
c- Calculer l'impédance Z du circuit.
4- Montrer que pour cette fréquence N du GBF, on peut obtenir un déphasage nul entre
l'intensité i(t) et la tension u(t), par une modification de la valeur de l'inductance L de la
bobine. De quel phénomène physique s'agit-il?
3/5

16
Figure 3
. _. 14
la
8
~ -r-~\
. Courbe
2 : .•... _ •• _ ~ L..•
4
2
-2
Teu.";;oll eu
V
Exercice 2 (5 points)
L'extrémité
5
d'une corde élastique est reliée à un vibreur qui lui impose un mouvement
vibratoire, transversal et sinusoïdal de fréquence N et d'amplitude a. L'équation horaire
de mouvement du point
5
est: ys(t) = a.sin(200n
t
+
ljls),où y,(t) est donnée en cm.
Ainsi, on a une onde qui prend naissance et se propage le long de la corde avec une
célérité v = 6 m.s''. Chaque point de la corde est repéré par son abscisse x(t) par rapport
à un repère d'espace (Oxy). Un dispositif approprié placé à l'autre l'extrémité de la corde
permet d'empêcher toute réflexion de l'onde. On négligera l'atténuation de l'amplitude.
1-a- Déterminer la fréquence N de vibration de la corde
b- Préciser la valeur de la phase initiale ljls de la source, sachant que le point
5
passe
par
a
dans le sens positif à l'instant t=O s.
c- Calculer la valeur de la longueur d'onde
Â.
de l'onde qui se propage.
2-a- Donner l'expression de l'équation horaire du mouvement d'un point M situé, au repos,
à une position d'abscisse x par rapport à la source
5.
b- Comparer la nature du mouvement d'un point MI. par rapport celle de la source,
sachant que Ml est situé, au repos, à une position d'abscisse Xl = 13,5 cm de 5.
3- A un instant tl ,l'onde atteint le point
M
z
situé au repos à une position d'abscisse
Xz
égale à 27,0 cm par rapport à 5 (position du front d'onde à cet instant).
0-
Déterminer la valeur de tl.
b- Justifier que
M
z
vibre en opposition de phase par rapport à 5.
C- Donner, à cet instant tl, le nombre et les abscisses des points qUi vibrent en
opposition de phase avec la source 5.
4/5
1
/
4
100%