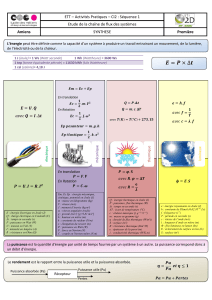
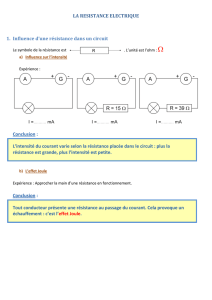
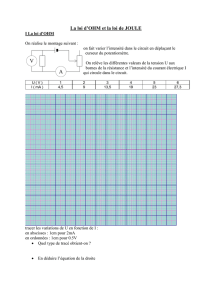
Chapitre 3 : Chaleur et premier principe

Chapitre 3 : Chaleur et premier principe

0. Préambule
• Dans ce chapitre, on travaillera principalement avec un système fermé.
• Système fermé : nombre de particules constant, pas d’échange : !N=0
• Pour rappel, on ne s’intéresse qu’aux situations d’équilibre.
• On étudiera la transformation d’un équilibre vers un autre.
transformation
Ui,V
i,N
Uf,V
f,N
Ti
Tf

1. Chaleur et énergie
• La chaleur est la forme d’énergie qui a mis le plus de temps à obtenir
son véritable statut. Lavoisier proposait que la chaleur était un fluide
invisible, le calorique.
• Joule a proposé vers 1850 que la chaleur était une forme d’énergie.
• Expérience de Joule :
énergie mécanique
énergie thermique
(élévation de T)
1 calorie = énergie nécessaire pour faire passer 1g d’eau de 14,5°C à 15,5°C
1 calorie = 4,186 J

2. Chaleur spécifique
• Lorsque l’on injecte de l’énergie à un système (Q) sans produire du travail
mécanique, la température du système augmente.
• Unité : chaleur spécifique
Q=cm∆T
• Expérience de Joule : chaleur spécifique de l’eau
• Attention au signe :
c[J/kgK]
c= 4186 J/kgK
∆T>0
∆T<0
Q<0
Q>0
le système reçoit de l’énergie
le système perd de l’énergie
• Diverses matières :
matière
eau
4186
fer
448
cuivre
387
or
129
c[J/kgK]

• Exemple numérique :
Un cowboy tire une balle de 2g à 200m/s. Elle est stoppée par un mur.
Si l’énergie est conservée, quelle est la variation de T de la balle?
La chaleur spécifique du métal de la balle est
c= 234 J/kgK
K=1
2mv2=1
2(2 10−3)(200)2= 40 J
∆T=Q
mc =40
2 10−3234 = 85.5K
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%