Programme et Livret des communications - Canceropole Nord

9èmes Journées
Scientifiques
Centre International
Deauville - France
18-20mai
2016
www.canceropole-nordouest.org
livret des
communications

29èmes Journées Scientiques du Cancéropôle Nord-Ouest - 18 au 20 mai 2016 – Deauville
SOMMAIRE
SOMMAIRE p 2
LISTING SESSION JEUNES CHERCHEURS PAR ORDRE ALPHABÉTIQUE p 3
EDITORIAL DU PRÉSIDENT p 4
PROGRAMME DES 9ÈMES JOURNÉES SCIENTIFIQUES 2016 p 5 - 9
CONFÉRENCES DE PRESTIGE p 10 - 16
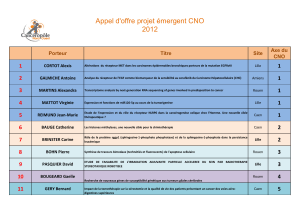
PROJETS EMERGENTS CNO : PRÉSENTATION DES RÉSULTATS
DE RECHERCHE p 17 - 28
SESSION JEUNES CHERCHEURS
Résumés des 10 communications orales sélectionnées
Résumés des communications afchées
p
p
29 - 39
40 - 103
- Axe 1 : Du développement et la validation de biomarqueurs
pronostiques et prédictifs à l’innovation thérapeutique p 41 - 86
- Axe 2 : Aspects cliniques et biologiques des hémopathies malignes B p 87 - 89
- Axe 4 : Cancer et neurosciences p 90 - 95
- Axe 5 : Cancers, individu et société p 96 - 103
PRÉSENTATION DES DIFFÉRENTES PLATEFORMES AU SEIN DU CNO
- Le centre de traitements des données p 105
- Les plateformes de génomique : Lille / Caen / Rouen p 106 - 108
- Les tumorothèques dans le Cancéropôle Nord-Ouest p 109
- La plateforme « Inégalités sociales et Cancer » du Cancéropôle Nord-Ouest p 110
- La plateforme Cancer et Cognition du Cancéropôle Nord-Ouest p 111
- L’Antenne Nord-Ouest de la plateforme nationale qualité de vie et Cancer p 112
PRÉSENTATION DE MATWIN p 113
CONVENTION DE PARTENARIAT CANCEROPOLE NORD-OUEST/ONCOLILLE p 114
LES CINQ AXES DE RECHERCHE DU CANCÉROPÔLE NORD-OUEST p 115

3
9èmes Journées Scientiques du Cancéropôle Nord-Ouest - 18 au 20 mai 2016 – Deauville
Communications orales et posters par ordre alphabétique
SESSION JEUNES CHERCHEURS
NOM n° de poster
ou com.
orale
n°
page NOM / Prénom n° de poster
ou com.
orale
n°
page
ANFRAY Clément 55 95 GROO Anne-Claire Com. orale 10 39
AUGUSTO Laëtitia 18 58 GUEDER Nahla 11 51
AURY-LANDAS Juliette 28 68 GUERNET Alexis Com. orale 6 35
BADAOUI Mehdi 9 49 HEDIR Siham 23 63
BAERT-DESURMONT Stéphanie 37 77 HELIOT Amélie 7 47
BAILLEUL Justine 15 55 HOFLACK Julien 5 45
BENHABILES Hana Com. orale 5 34 JARRAYA Hajer 19 59
BENKHELIFA Sarra 36 76 KASPER Edwige Com. orale 8 37
BERTHE Julie 16 56 KORA Had 39 79
BODY Simon 48 88 LAMBERT Mélanie Com. orale 4 33
BONNEFOND Marie-Laure 22 62 LANOS Raphaël et Germain Paimparay 1 41
BOURJILA Hanae 51 91 LEBLOND Marine 54 94
BUSTANY Sophie 47 87 LEVEQUE Romain 12 52
CAMUS Vincent Com. orale 3 32 LHUISSIER Eva 29 69
CASTEL Hélène Com. orale 2 31 LHUISSIER Eva 30 70
COLY Pierre-Michaël 53 93 LIGIER Karine Com. orale 1 30
COUTURE Alexandre 38 78 LIGIER Karine 56 96
DAVY Grégoire 20 60 LIGIER Karine 57 97
DE PASCALE Martina 24 64 LUCAS Mélodie 59 99
DELLIAUX Carine 40 80 LUCAS Mélodie 60 100
DENIS Camille 25 65 MAILLE Elodie 6 46
DONNADIEU Jérôme Com. orale 9 38 MUSTAPHA Rami 44 84
DUBOIS Sydney 49 89 PAGET Sonia 3 43
DUBOIS Martine 50 90 PETIGNY-LECHARTIER Cécile 21 61
DUMORTIER Mandy 41 81 PLOUVIER Sandrine 58 98
DUPEL Estelle 43 83 QUILLET Aurélien 42 82
DUPLAQUET Leslie 31 71 RENAUD Sarah 8 48
DUPRET Barbara 45 85 ROGEZ Bernadette 13 53
EL AMRANI Mehdi 33 73 SEFRIOUI David Com. orale 7 36
EL AMRANI Mehdi 34 74 SFAXI Samah 26 66
EL AMRANI Mehdi 35 75 SOUKARIEH Omar 2 42
EL AMRANI Mehdi 62 102 TIAN Lu 14 54
FERMEY Pierre 27 67 VALABLE Samuel 46 86
FERMEY Pierre 52 92 VAUTRIN Alexia 17 57
FLEUROT Emmanuelle 10 50 VERMEULIN Thomas 61 101
GIACOBBI Anne-Sophie 32 72 ZERDOUMI Yasmine 4 44

49èmes Journées Scientiques du Cancéropôle Nord-Ouest - 18 au 20 mai 2016 – Deauville
Les journées scientiques du Cancéropôle Nord-Ouest ont pour double objectif de
faire un bilan annuel de nos activités et d’apporter un éclairage sur des questions
d’intérêt majeur pour la recherche sur le cancer et le transfert de ses résultats au
prot des patients.
Nos 9èmes journées s’inscrivent pleinement dans cette démarche.
Elles commenceront avec une session exceptionnelle tournée vers deux thématiques
d’une actualité brûlante : les progrès fulgurants de l’immunothérapie des cancers et
le problème grandissant du nancement des traitements innovants.
Elles vous permettront ensuite de mesurer les premiers résultats de la stratégie
globale mise en place depuis un an et demi dans le cadre de notre nouvelle contrac-
tualisation avec l’INCa et des missions spéciques qu’elle nous cone. Une recom-
mandation forte était notamment de développer un partenariat renforcé avec les
collectivités territoriales. Un succès remarquable a été la signature n 2015 d’une
convention avec chacune des Régions de l’interrégion Nord-Ouest permettant un
soutien nancier coordonné de notre plate-forme de mesure des inégalités sociales.
Ces journées démontreront également le dynamisme de nos équipes de recherche et
des axes stratégiques dans lesquels elles s’inscrivent. Leur programme fera comme
chaque année une très large place aux jeunes chercheurs et au bilan des projets sou-
tenus dans le cadre de notre appel à projets émergent. Cet appel est devenu annuel
et nous permet donc de nancer deux fois plus de projets que précédemment. C’est
une grande satisfaction que d’observer la diversité, la pluridisciplinarité croissante et
le caractère innovant de ces projets.
Un point sera fait sur le développement de la recherche clinique, une mission dans
laquelle le Cancéropôle s’investit depuis plusieurs années et pour laquelle il a noué un
partenariat exemplaire avec le GIRCI Nord-Ouest, avec lequel il conance un appel à
projets émergents dédié.
Nos journées seront aussi comme chaque année l’occasion d’entendre des conféren-
ciers invités de haut niveau. Entamées avec des experts de l’immunothérapie et de
l’évaluation du nancement des médicaments, elles se termineront par une confé-
rence de prestige sur l’oncogène Met, un sujet cher à plusieurs équipes du Cancéro-
pôle Nord-Ouest.
Excellentes journées à toutes et à tous !
Pierre Formstecher
Président du Cancéropôle Nord-Ouest
Editorial du Président

5
9èmes Journées Scientiques du Cancéropôle Nord-Ouest - 18 au 20 mai 2016 – Deauville
Programme
Mercredi 18 mai
2016 - A.Midi
Enregistrement des participants dès 13h30
13h55 Café d’accueil
14h25 Introduction des journées
Véronique Pancré
LES NOUVELLES VOIES D’IMMUNOTHERAPIE
14h30 - 15h15 L’immunothérapie : des prémices de la costimulation dans les années 80 aux
médicaments actuels et en devenir. (p11)
Daniel OLIVE ( Institut de Cancérologie et d’Immunologie de Marseille)
15h15 - 16h00 CD39 une nouvelle cible thérapeutique pour l’immunothérapie des cancers. (p12)
Nathalie BONNEFOY (Institut de Recherche en Cancérologie de Montpellier)
16h00 - 16h45 L’immunothérapie du point de vue du clinicien : exemple du cancer du poumon. (p13)
Alexis CORTOT (CHRU de Lille)
16h45 - 17h15 Pause
LE FINANCEMENT DES TRAITEMENTS INNOVANTS
17h15 - 18h00 Evaluation économique des médicaments contre le cancer :
quelles méthodes, quels enjeux ? (p14)
Lise ROCHAIX (Centre d’Economie de la Sorbonne)
18h00 - 18h20 Valeur, prix et coût du médicament : les points d’équilibre. (p15)
Dana VIGIER (Vice-Présidente Market Access et Affaires Gouvernementales -
Bristol-Myers Squibb France)
DISCUSSION GÉNÉRALE
19h00 - 20h15 Visite des posters
20h15 - 21h45 Cocktail dînatoire autour de l’espace poster
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
1
/
116
100%